TRAVAUX
DIRIGES : " ATOMES ET MOLECULES " - Cours de Thierry Briere
Tous les cours, sujets d’examens et les corrigés des TD seront accessibles sur le site : www.chimie-briere.com
Série 2 : SPECTRE DE l'HYDROGENE - Modèle de
BOHR
Exercice 1 :
Le spectre de l'hydrogène peut se
décomposer en plusieurs séries. On se limitera ici aux cinq premières nommées
respectivement série de Lyman, Balmer, Paschent, Bracket et Pfund.
a) A quels phénomènes physiques
correspondent ces raies ?
b) Quelle est l'expression générale
donnant la longueur d'onde d'une raie ?
c) Les raies de chaque série sont
encadrées par deux raies limites nommées llim pour la limite inférieure et l1 pour la limite supérieure. A quoi correspondent ces
deux limites ?
d) Etablir une formule générale
permettant le calcul de ces deux limites. Calculer l1
et llim pour les 4 premières séries.

Passage de l’infini à n :
1 / l1 = RH
(1/n2 –1/p2) = RH / n2 => l1 = n2 / RH
Passage de n + 1 à n :
1 / l2 = RH
(1/n2 –1/(n+1)2) = RH [ (n + 1)2 -
n2] / [n2 (n+1)2] => l2 = n2 (n + 1)2 / [ ( 2n + 1 ) RH]
|
Série |
l1 ( nm) |
l2 (nm) |
|
Lyman (n = 1) |
91 |
122 |
|
Balmer ( n = 2 ) |
365 |
656 |
|
Paschen ( n = 3 ) |
820 |
1875 |
|
Pfund ( n = 4 ) |
1458 |
4051 |
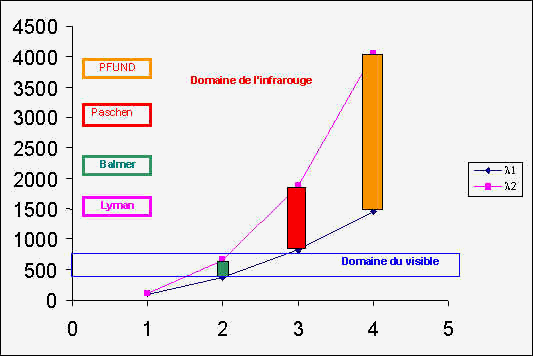
Remarque :
Les séries sont de plus en plus étalées et
on observe un chevauchement dès n = 4.
On finit donc pour n élevé par obtenir un
spectre quasi continu.
Pour certains atomes émettant dans le
visible, on pourra donc obtenir une lumière pratiquement blanche, d’où
l’utilisation pour l’éclairage "au néon ".
Visible de 400 à 750 nm.
Représentation
graphique.
Exercice 2 :
Dans l'atome d'hydrogène, l'énergie de
l'électron dans son état fondamental est égale à -13,6 eV.
a) quelle est en eV, la plus petite quantité
d'énergie qu'il doit absorber pour :
- passer au 1° état excité ?
- passer du premier état excité à l'état
ionisé ?
b) Quelles sont les longueurs d'onde des
raies du spectre d'émission correspondant au retour :
- de l'état ionisé au 1° état excité ?
- Du premier état excité à l'état
fondamental ?
DEp,n = E0 (1/p2-1/n2)
avec n > p
DE2,1
= E0 (1/12-1/22) = 3/4 E0 = 3/4 *
13,6 = 10,2 eV = 1,63 10-18 J
DE¥ ,2
= E0 (1/22-1/¥ 2) = 1/4 E0
= 1/4 * 13,6 = 3,4 eV = 5,4 10-19 J
DE = h n Û n = DE / h =
C / l Û l = h C / DE
l ¥ ,2
= h C / DE¥ ,2
= 6,62 10-34 * 3 108 / 5,4 10-19 = 3,678 10-7
m
l ¥ ,2
= 367,8 nm
l 2,1 = h C / DE2,1
= 6,62 10-34 * 3 108 / 1,63 10-18 = 1,226 10-7
m
l 2,1 = = 122,6 nm
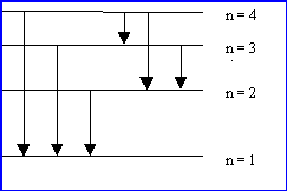
Exercice 3 :
Si l’électron de l’Hydrogène est excité
au niveau n=4, combien de raies différentes peuvent-elles être émises lors du
retour à l’état fondamental. Classer les transitions correspondantes par
longueurs d'onde décroissantes du photon émis.
6 raies possibles :
Modèle de Bohr : En = - E0 / n2
Formule de Rydberg : 1/l = RH (1/n2
– 1/p2)
E n,p
= -E0 / n2 + E0 / p2 = E0
(1/p2 - 1/n2)
E = h . n et n = C / l
E0
= h C RH = 6,62 10-34 * 3 108 *
1,097 107
E0
= 2,18 10-18 J ( 13,6 eV )
|
Raie - Transition |
Energie (J ) |
Fréquence n ( 1015 Hz ) |
Longueur d’onde (nm) |
Domaine spectral |
Série |
|
4
à 3 |
1,06 10-19 |
0,16 |
1874 |
I.R |
Bracket |
|
4
à 2 |
4,09 10-19 |
0,62 |
486 |
Visible |
Balmer |
|
4 à 1 |
2,04 10-18 |
3,09 |
97,2 |
U.V |
Lyman |
|
3
à 2 |
3,02 10-19 |
0,46 |
656 |
Visible |
Balmer |
|
3 à 1 |
1,93 10-18 |
2,93 |
102,5 |
U.V |
Lyman |
|
2 à 1 |
1,63 10-18 |
2,5 |
121,5 |
U.V |
Lyman |
Remarques :
- Une erreur fréquente consiste à penser que
les niveaux sont équidistants, ce qui ramènerait le nombre de raies a trois
seulement.
- on peut vérifier que la valeur obtenue
pour l est du bon ordre de grandeur si on se rappelle que la série de Lyman
(n=1) est dans l'Ultra-Violet, que la série de Balmer (n=2) est dans le visible
et que toutes les autres séries sont dans l'Infra.Rouge.

Exercice 4 :
a) Calculer l'énergie à fournir pour ioniser
à partir de leur état fondamental les ions He+; Li2+et Be3+
b) Quelles sont les longueurs d'onde des
raies limites de la série de Balmer pour He+ ?
Atomes hydrogénoïdes : En = - E0
* [ Z2 / n2 ]
He+
: Z = 2 Þ En = - E0
* [ 22 / n2 ] = - 4 E0 / n2
= - 54,4 / n2
E.I He+
= 54,4 eV
Li2+
: Z = 3 Þ En = - E0
* [ 32 / n2 ] = - 9 E0 / n2
= - 122,4 / n2
E.I Li2+ = 122,4 eV
Be3+
: Z = 4 Þ En = - E0
* [ 42 / n2 ] = - 16 E0 / n2
= - 217,6 / n2
E.I Be3+
= 217,6 eV
b) Balmer : retour à n = 2
DE3,2 = E3
- E2 = - 54,4 / 22 + 54,4 / 32 = 54,4 (1/4 -
1/9) = 7,556 eV = 1,21 10-8 J
l = h c / DE = 164,3 nm
DE¥ ,2 = E¥ - E2 = - 54,4 / 4 = 13,6 eV =
2,18 10-18 J
l = h c / DE = 91,3 nm
Exercice 5 :
Pour passer du niveau d'énergie n=2 au
niveau m=4, l'électron d'un atome d'hydrogène absorbe un photon de longueur
d'onde l. Calculer l.
Formule de Rydberg : 1 / l = RH (1/n2 - 1/p2)
1 / l = 1,096 107
(1/22 - 1/42)
1 / l = 2055000
l = 4,86610-7 m = 486,6 nm
Cette raie fait partie de la série de
Balmer, elle est bien dans le domaine du visible.