TRAVAUX DIRIGES : « ATOMES
ET MOLECULES » - Cours de Thierry Briere
Série 4 : Modèle
de Slater - Propriétés atomiques
Exercice
1 :
On donne les valeurs expérimentales des
énergies de première ionisation EI1 (exprimées en kJ.mol-1) de
quelques éléments de la deuxième période
|
Symbole |
Be |
B |
C |
N |
O |
|
Z |
4 |
5 |
6 |
7 |
8 |
|
EI1
(kJ.mol-1) |
899 |
800 |
1086 |
1402 |
1314 |
a)Comment passe-t-on des kJ.mol-1
aux eV ?
b) Convertir ces énergies en eV.
c) Par utilisation des approximations
hydrogénoïdes de Slater calculer ces énergies de première ionisation.
d) Comparer les valeurs expérimentales
aux valeurs obtenues par le calcul.
e) Justifier les écarts observés par
comparaison des schémas de Lewis (sous forme de cases quantiques) des
« atomes neutres » et des ions correspondants.
CORRIGE
On donne les valeurs expérimentales
des énergies de première ionisation des éléments de la 2° période EI1
exprimées en KJ.mol-1
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
520 |
899 |
800 |
1086 |
1402 |
1314 |
1678 |
2084 |
a)Comment passe-t-on des kJ.mol-1
aux eV ?
KJ / mole * 1000 / N / e à eV / atome
N * e = F = 96500 C
KJ mol-1 / 96,5 à eV/atome
b) Convertir ces énergies en eV.
|
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
5,4 |
9,3 |
8,3 |
11,3 |
14,5 |
13,6 |
17,4 |
21,6 |
c) Par utilisation de l’approximation
hydrogénoïde de Slater calculer ces énergies de première ionisation.
Nous allons montrer sur deux exemples comment on peut
calculer la valeur approximative de l'énergie d’ionisation grâce aux
approximations hydrogenoides de Slater.
Oxygène ( Z = 8 )
|
O |
1s2 |
2s2 , 2p4 |
|
|
2 E1 |
6 E2 |
|
O+ |
1s2 |
2s2 , 2p3 |
|
|
2 E1 |
5 E'2 |
O è O+
+ 1 e-
Energie de première ionisation
E.I1 = EO+
- EO
E O+ = 2 E1
+ 5 E'2
EO = 2 E1
+ 6 E2
E.I1 = 5 E'2
- 6 E2
Calcul de Z*E2 et E2 :
Z*E2 = 8 – (5 * 0,35)
- (2 * 0,85) = 4,55
E2 = -13.6 * 4,552
/ 4 = -70,39 eV
Calcul de Z*E'2 et E'2 :
Z*E'2 = 8 – (4 * 0,35) - (2 *
0,85) = 4,9 (soit plus simplement 4,55 + 0,35 = 4,9)
E'2 = -13.6 * 4,92 / 4 =
-81,63 eV
Calcul de
E.I1 :
E.I1 = 5 E'2 - 6 E2
= (5 * -81,63) - (6 * -70,39) = 14,2 eV
Carbone ( Z = 6)
|
C |
1s2 |
2s2 , 2p2 |
|
|
2 E1 |
4 E2 |
|
C+ |
1s2 |
2s2 , 2p1 |
|
|
2 E1 |
3 E'2 |
C è C+ + 1 e-
Energie de
première ionisation :
E.I1 = EC+ - EC
E C+ = 2 E1
+ 3 E'2
EO = 2 E1
+ 4 E2
E.I1 = 3 E'2
- 4 E2
Calcul de Z*E2 et E2 :
Z*E2 = 6 – (3 * 0,35)
- (2 * 0,85) = 3,25
E2 = -13.6 * 3,252
/ 4 = -35,91 eV
Calcul de Z*E'2 et E'2 :
Z*E'2 = 6 – (2 * 0,35) - (2 * 0,85) = 3,6 (soit plus
simplement 3,25 + 0,35 = 3,6)
E'2 = -13.6 * 3,62 / 4 = -44,06 eV
Calcul de E.I1 :
E.I1 = 3 E'2 - 4 E2
= (3 * -44,06) - (4 * -35,91) = 11,5 eV
d) Comparer les valeurs
expérimentales aux valeurs obtenues par le calcul.
Résultats
:
|
|
Valeur
calculée |
Valeur
expérimentale |
Ecart (
% ) |
|
Li |
5,7 |
5,4 |
6,4 |
|
Be |
7,9 |
9,3 |
-15,4 |
|
B |
9,8 |
8,3 |
17,8 |
|
C |
11,5 |
11,3 |
1,4 |
|
N |
12,9 |
14,5 |
-10,9 |
|
O |
14,2 |
13,6 |
4,1 |
|
F |
15,2 |
17,4 |
-12,8 |
|
Ne |
16,0 |
21,6 |
-26,0 |
e) Justifier les écarts observés
par comparaison des schémas de Lewis (sous forme de cases quantiques) des
« atomes neutres » et des ions correspondants.
Interprétation
:
Cette méthode simple de calcul permet d’atteindre l’ordre de
grandeur de l’énergie de première ionisation d’un atome. L’écart moyen est de 6
%, cette précision est appréciable eut égard à la simplicité du modèle utilisé.
La courbe des valeurs calculées est régulière alors que la courbe expérimentale
présente des discontinuités.
·
La tendance est à une élévation de l’énergie d’ionisation
quand on passe de Li a F. Cette tendance correspond à l’augmentation régulière
du Z*2s,2p. En effet, si Z* est plus élevé l’électron est mieux
retenu par l’atome et donc l’énergie nécessaire à son arrachement augmente.
·
L’augmentation régulière du Z* est due au fait que l’effet
d’écran augmente moins vite que la valeur de Z. Pendant que s augmente de 0,35
pour chaque électron ajouté, Z augmente d’une unité. Finalement : DZ* = DZ – Ds
= 1 – 0,35 = 0,65
Cette tendance générale à
l’augmentation souffre deux " accidents " correspondant à B et N pour
lesquels on observe une diminution de l’énergie d’ionisation. On peut
comprendre (sinon expliquer) ces accidents en examinant la structure électroniques
des atomes et ions correspondants. Rappelons la règle: " une couche ou
sous-couche à demi remplie ou complètement remplie apporte une stabilité
supplémentaire ".
Si cette règle est respectée, les
atomes ayant une couche de ce type seront très stables et donc difficiles à
ioniser puisqu’on perd alors cette stabilité supplémentaire ; leur énergie
d’ionisation sera alors "anormalement élevée ".
Les atomes de ce type sont Be, N
et Ne et on trouve effectivement que la valeur expérimentale de l’énergie
d’ionisation est plus élevée que sa valeur calculée.
Inversement, les ions possédant
une couche remplie ou demi remplie seront très stables et l’atome correspondant
aura donc une énergie d’ionisation "anormalement faible ".
Les atomes de ce type sont B et O
et on trouve effectivement que la valeur expérimentale de l'énergie
d’ionisation est plus faible que sa valeur calculée.
Le carbone n’appartient à aucune
de ces catégories et son énergie d’ionisation calculée est très proche de la
valeur expérimentale.
Le Lithium est un cas particulier,
sa couche de valence 1s1 le placerait à la limite dans la première
catégorie, mais l’ion forme possède une couche totalement remplie (1s2).
C’est cet effet qui l’emporte et on trouve que la valeur expérimentale de l’énergie
d’ionisation est plus faible que sa valeur calculée.
Reste enfin le cas de l’atome de
Fluor qui comme le carbone devrait conduire à des valeurs calculée et
expérimentale proches. Ce n’est pas le cas, et la valeur expérimentale est
beaucoup plus élevée que la valeur calculée. Le fort écart observé pour cet
atome traduit la difficulté d’arracher des électrons alors qu’il suffirait d’en
ajouter un pour atteindre la structure de gaz rare. C’est une manifestation de
la règle de l’octet. Enfin, cela traduit aussi la forte electronégativité de
l’atome de Fluor qui retient fortement les électrons.
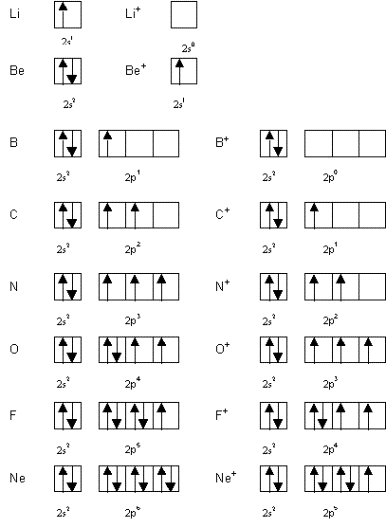
Exercice 2 :
Evaluer les énergies d'ionisation successives de l'atome de Béryllium.
Comparer aux valeurs expérimentales.
Conclusion.
Numéro
|
Valeur |
Numéro
|
Valeur |
|
E.I.1 |
9,28 eV |
E.I.3 |
155 eV |
|
E.I.2 |
18,1 eV |
E.I.4 |
217 eV |
|
Be |
[1s2] |
[2s2] |
|
|
|
|
E1 |
E2 |
EBe = 2 E1 + 2 E2 |
|
|
|
|
|
|
|
|
Be+ |
[1s2] |
[2s1] |
|
|
|
|
E1 |
E'2 |
EBe+ = 2 E1 + E'2 |
|
|
|
|
|
|
E.I1 = EBe+ - EBe = E'2 - 2 E2 |
|
Be2+ |
[1s2] |
|
|
|
|
|
E1 |
|
EBe2+ = 2 E1 |
|
|
|
|
|
|
E.I2 = EBe2+ - EBe+
= -E'2 |
|
Be3+ |
[1s1] |
|
|
|
|
|
E'1 |
|
EBe3+ = E'1 |
|
|
|
|
|
|
E.I3 = EBe3+ - EBe2+
= E'1 - 2 E1 |
|
Be4+ |
|
|
EBe4+ = 0 |
|
|
|
|
|
|
E.I4 = EBe4+ - EBe3+
= -E'1 |
Calcul
des diverses énergies :
Z*E2 = 4 - 0,35
- (2 * 0,85 ) = 1,95
E2 = -13,6 *
1,952/22 = -12,92 eV
Z*E'2 = 4 - (2 * 0,85 ) = 1,95 + 0,35 = 2,3
E'2 = -13,6 * 2,32/22 = -17,99 eV
Z*E1 = 4 - 0,3 = 3,7
E1 = -13,6 *
3,72/12 = -186,18 eV
Z*E'1 = 4
E'1 = -13,6 * 42/12 = -217,6 eV
Calcul
des énergies d'ionisation successives :
E.I1 = EBe+ -
EBe = E'2 - 2 E2 = -17,99
- ( 2 * -12,92 ) = 7,85 eV
E.I2 = EBe2+ -
EBe+ = -E'2
= 17,99 eV
E.I3 = EBe3+ -
EBe2+ = E'1
- 2 E1 = -217,6
- ( 2 * -186,18 ) = 154,76 eV
E.I4 = EBe4+ -
EBe3+ = -E'1
= 217,6 eV
Comparaison
avec les valeurs expérimentales :
|
|
|
E.I calculé |
E.I expérimental |
Ecart
( % ) |
|
E.I1 |
Be à Be+
+ 1 e- |
7,85 eV |
9,28 eV |
15,4 |
|
E.I2 |
Be+ à Be2+
+ 1 e- |
17,99 eV |
18,1 eV |
-0,6 % |
|
E.I3 |
Be2+ à Be3+
+ 1 e- |
154,76 eV |
155 eV |
-0,15 % |
|
E.I4 |
Be3+ à Be4+
+ 1 e- |
217,6
eV |
217
eV |
0,3
% |
On
voit que l'accord entre valeurs calculées et expérimentales est excellent sauf
pour la première énergie d'ionisation. Ce résultat est général, les valeurs
calculées par ce modèle simple sont en bon accord avec les valeurs
expérimentales, l'écart observé est généralement plus important pour la
première énergie d'ionisation. (Les valeurs des
énergies d’ionisation augmentant régulièrement (effet d’écran diminué par
l’arrachement des électrons, l’erreur commise devient rapidement négligeable.)
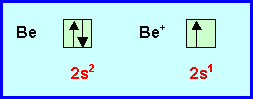
Ce
mauvais accord est justifiable par la règle de la couche remplie ou 1/2
remplie.
Be possédant une couche remplie est fortement stabilisé.
Be+ qui ne
possède qu'une couche 1/2 remplie est moins bien stabilisé.
Le passage de Be à Be+ est donc difficile et la
première énergie d'ionisation de Be est anormalement élevée ce qui justifie que
la valeur calculée qui ne tient pas compte de cet effet soit trop faible par
rapport à la réalité.
Exercice 3 : On donne pour
les éléments des 1° et 2° groupes A à F les valeurs de EI1 et EI2
en eV.
Identifiez chacun de ces éléments,
sachant qu’ils appartiennent aussi aux quatre premières lignes :
A : 4,3 - 31,8 B : 9,3 - 18,2 C : 6,1 - 11,9
D : 5,1 - 47,3 E : 5,4 - 75,6 F : 7,6 - 15,0
On
sait que les éléments considérés appartiennent aux 4 premières lignes et au
deux premiers groupes. H
est exclu puisqu'il ne possède qu'un électron et n'a donc qu'une seule énergie
d'ionisation.
Li Be Na Mg K Ca
Le
groupe auquel appartient un élément est identifiable par le saut observé dans
les valeurs des énergies d'ionisation successives. Ce saut correspond a l'ion
possédant la structure électronique d'un gaz rare.
Pour
trouver ce saut il suffit ici de comparer les valeurs de EI1 et EI2.
On
voit que pour les éléments B, C et F la valeur de E.I1 est environ deux fois plus élevée que celle de
E.I1. Pour les éléments A , D et E ce rapport est beaucoup plus
élevé.
A, D et E appartiennent donc au groupe 1 (E.I2 très
élevé)
B, C et F appartiennent au groupe 2.
Pour
identifier la période de chacun il suffit de comparer les valeurs de E.I1
E.I
dans un même groupe augmente de bas en haut (sens inverse du rayon atomique) et
l'élément de plus grande énergie d'ionisation est donc situé le plus haut.
A = K ; D = Na ; E = Li
B = Be ; C = Mg ; F = Ca
Exercice
4 : (suite de exercice 7 série
précédante)
Rayons de
Covalence de Ga (Z=31) et As (Z=33)
On connaît les rayons de covalence de ces
deux éléments qui sont respectivement 1,21 A° et 1,26 A°.
1) Quelle
grandeur doit-on calculer si on veut comparer de façon simple le rayon de deux
atomes ?
Le rayon atomique est
proportionnel à n2/Z*
2) Déterminer pour
As et Ga les valeurs respectives de n et Z* puis attribuer à chaque élément son
rayon de covalence.
Ga Z = 31 : 1s2
2s2 2p6 3s2 3p6 3d10 4s2 4p1
n = 4
Z* = 31 – (2 * 0,35) – (18 *
0,85) – (10 * 1) = 5
n2 / Z* = 3,2
As Z = 33 : 1s2
2s2 2p6 3s2 3p6 3d10 4s2 4p3
n = 4
Z* = 33 – (4 * 0,35) – (18 *
0,85) – (10 * 1) = 6,3
n2 / Z* = 2,54
L’atome
de Gallium est donc plus gros que l’atome d’Arsenic, cela est conforme avec la
diminution du rayon atomique quand on se déplace da gauche à droite dans une
même ligne de la classification.
As = 1,21 A° et Ga = 1,26 A°.
3)
L'Arsenic donne trois
ions différents dont les rayons ioniques on pu être déterminés, les
valeurs données dans les tables sont les suivantes : 2,22 A° , 0,58 A° et
0,47 A°. En justifiant simplement votre réponse, attribuer à chacun son rayon
ionique.
L’ajout d’électrons pour donner des anions augmente l’effet
d’écran, d’ou une diminution de Z* et une augmentation de n2/Z* (n
restant inchangé) et donc un accroissement du rayon atomique.
L’enlèvement d’électrons pour donner des cations diminue
l’effet d’écran, d’ou une augmentation de Z* et une diminution de n2/Z*
(n restant inchangé) et donc une diminution du rayon atomique.
L’anion As3-
est le plus volumineux soit 2,22 A°.
Le cation As5+
est le plus petit soit 0,47 A°.
Le cation As3+
est intermédiaire soit 0,58 A°.
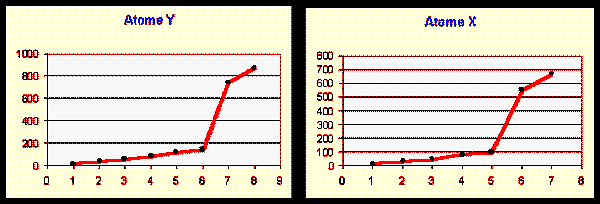
Exercice 5
: Soient deux
atomes X et Y. On donne pour ces deux atomes leurs énergies d'ionisation
successives
|
Energies
d'ionisation en eV |
Atome X |
Atome Y |
|
E.I.1 |
14,5 |
13,6 |
|
E.I.2 |
29,6 |
35,1 |
|
E.I.3 |
47,4 |
54,9 |
|
E.I.4 |
77,5 |
77,4 |
|
E.I.5 |
97,9 |
113,9 |
|
E.I.6 |
551,9 |
138,1 |
|
E.I.7 |
666,8 |
739,1 |
|
E.I.8 |
Non
définie |
871,1 |
|
E.I.9 |
Non
définie |
Non
définie |
1) A partir de l'évolution
des valeurs de leurs énergies d'ionisation successives : Montrer qu'il est
possible de déduire leur position dans la classification périodique (colonne et
ligne) et donc d'identifier sans aucun
calcul ces deux atomes. On justifiera clairement la réponse.
Atome X : On voit que la sixième ionisation est très difficile,
l'ion X5+ possède donc une structure de gaz rare en ns2
np6 , X appartient donc à la colonne 15 de la classification, il peut
s'agir de l'azote ou du phosphore. Puisque E.I.8 n'est pas définie il s'agit de
l'azote.
Atome Y : On voit que la septième ionisation est très difficile,
l'ion Y6+ possède donc une structure de gaz rare en ns2
np6 , Y appartient donc à la colonne 16 de la classification, il
peut s'agir de l'oxygène ou du soufre. Puisque E.I.9 n'est pas définie il
s'agit de l'oxygène.
2)
Par
le calcul d'une énergie d'ionisation qu'on choisira vérifier par comparaison
avec les valeurs expérimentales que la valeur trouvée est en accord avec votre
identification précédente.
Le plus simple
et le plus rapide est de calculer l'énergie d'ionisation correspondant à l'ion
hydrogénoïde de l'élément considéré car elle est directement donnée par E = -E0
Z2.
Atome X :
Supposons
qu'il s'agisse de l'azote : Z = 7 et E.I.7 = -13,6 * 72 = 666,4 eV
La valeur
de l'énergie de septième ionisation de X est de 666,8 eV, l'accord est
excellent : X = N
Atome Y :
Supposons
qu'il s'agisse de l'oxygène : Z = 8 et E.I.8 = -13,6 * 82 = 870,4 eV
La valeur
de l'énergie de huitième ionisation de Y est de 871 eV, l'accord est excellent:
Y = O
On peut à
priori calculer n'importe laquelle des énergies d'ionisation successive, le
tableau suivant donne les résultats obtenus avec la technique habituelle.
Atome X :
Supposé être l'atome d'azote
|
|
N |
N+ |
N2+ |
N3+ |
N4+ |
N5+ |
N6+ |
N7+ |
|
1s |
2 |
2 |
2 |
2 |
2 |
2 |
1 |
0 |
|
Z*1s |
6,7 |
6,7 |
6,7 |
6,7 |
6,7 |
6,7 |
7 |
|
|
E 1s |
-610,5 |
-610,5 |
-610,5 |
-610,5 |
-610,5 |
-610,5 |
-666,4 |
0 |
|
2s 2p |
5 |
4 |
3 |
2 |
1 |
0 |
0 |
0 |
|
Z* 2s2p |
3,9 |
4,25 |
4,6 |
4,95 |
5,3 |
|
|
|
|
E 2s2p |
-51,7 |
-61,4 |
-71,9 |
-83,3 |
-95,5 |
0 |
0 |
0 |
|
E totale |
-1480 |
-1467 |
-1437 |
-1388 |
-1317 |
-1221 |
-666,4 |
0 |
|
E.I |
E.I.1 |
E.I.2 |
E.I.3 |
E.I.4 |
E.I.5 |
E.I.6 |
E.I.7 |
|
|
|
12,92 |
29,818 |
49,215 |
71,111 |
95,506 |
554,608 |
666,4 |
|
|
EI (X) |
14,5 |
29,6 |
47,4 |
77,5 |
97,9 |
551,9 |
666,8 |
|
|
Ecart % |
-10,90 |
0,74 |
3,83 |
-8,24 |
-2,45 |
0,49 |
-0,06 |
|
On voit que
le calcul donne de très bons résultats (écarts inférieurs à 4 %) sauf pour
E.I.1 (11% d'écart) et E.I.4 (8% d'écart). Ces exceptions s'expliquent par des
structures particulièrement stables de l'état de départ, sous couche 2p demi
remplie pour N et sous couche 2s remplie pour N3+. Il est donc
normal que les valeurs calculées soient dans ces cas (E.I.1 et E.I.4) nettement
inférieures aux valeurs expérimentales correspondantes.
Atome Y : Supposé être
l'atome d'oxygène
|
|
O |
O+ |
O2+ |
O3+ |
O4+ |
O5+ |
O6+ |
O7+ |
O8+ |
|
1s |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
1 |
0 |
|
Z*1s |
7,7 |
7,7 |
7,7 |
7,7 |
7,7 |
7,7 |
7,7 |
8 |
|
|
E1s |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-870,4 |
0 |
|
2s 2p |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
|
|
|
Z* 2s2p |
4,55 |
4,9 |
5,25 |
5,6 |
5,95 |
6,3 |
|
|
|
|
E2s2p |
-70,4 |
-81,6 |
-93,7 |
-106,6 |
-120,4 |
-134,9 |
0 |
0 |
0 |
|
E totale |
-2035 |
-2021 |
-1987,5 |
-1933 |
-1853 |
-1748 |
-1613 |
-870,4 |
0 |
|
EI |
E.I.1 |
E.I.2 |
E.I.3 |
E.I.4 |
E.I.5 |
E.I.6 |
E.I.7 |
E.I.8 |
|
|
|
14,2 |
33,3 |
55,0 |
79,1 |
105,8 |
134,9 |
742,3 |
870,4 |
|
|
EI (Y) |
13,6 |
35,1 |
54,9 |
77,4 |
113,9 |
138,1 |
739,1 |
871,1 |
|
|
Ecart % |
4,12 |
-5,07 |
0,14 |
2,24 |
-7,12 |
-2,28 |
0,43 |
-0,08 |
|
On voit
que le calcul donne de très bons résultats (écarts inférieurs à 3 %) sauf pour
E.I.1 (4% d'écart), E.I.2 (5% d'écart) et E.I.5 (7% d'écart).
Ces
exceptions s'expliquent :
- soit par des structures particulièrement stables de l'état de départ, sous couche 2p demi remplie pour O+ et sous couche 2s remplie pour O4+. Il est donc normal dans ces cas (E.I.2 et E.I.5) que les valeurs calculées soient nettement inférieures aux valeurs expérimentales correspondantes.
soit par des structures particulièrement stables
de l'état d'arrivée, sous couche 2p demi remplie pour O+. Il est
donc normal que les valeurs calculées soient dans ces cas (E.I.1) nettement
supérieures aux valeurs expérimentales correspondantes.
Exercice 6
:
Pour l’atome de Chlore (Z=17) évaluer :
a) l’énergie de première ionisation (Cl
--> Cl+)
b) l’énergie de fixation électronique
(Cl --->Cl-) et l'électroaffinité (E.A).
c) l’électronégativité dans l’échelle
de Mulliken : XM = 0,21 (EI + EA)
d) le rayon de covalence : R (A°) =
0,215 (n2/Z*) + 0,148 n +
0,225
e) l’électronégativité dans l’échelle
d’Alred et Rochow.
XA-R= 0,34 (Z*/R2 )+ 0,67 (R en A°)
f) Comparer les valeurs calculées aux valeurs données dans les tables.
Cl : Z = 17 1s2, 2s2, 2p6,
3s2, 3p5
Cl
1s2 2s2,2p6 3s2,3p5 Cl+ 1s2 2s2,2p6
3s2,3p4
Cl- 1s2 2s2,2p6 3s2,3p6
E1 E2 E3 E1 E2 E’3 E1
E2 E’’3
ECl = 2 E1 + 8 E2
+ 7 E3 ECl+
= 2 E1 + 8 E2 + 6 E’3 ECl- = 2 E1
+ 8 E2 + 8 E’3
Cl à Cl+ + e- E.I = ECl+ - ECl = 6 E’3
– 7 E3 ( E.I = énergie d’ionisation )
Cl + e- à Cl- Efe = ECl- - ECl =
8 E’’3 – 7 E3 ( Efe = énergie de fixation électronique)
Z*Cl
= 17 – ( 6 * 0,35 ) – ( 8 * 0,85 ) – 2 = 6,1
Z*Cl+
= Z*Cl + 0,35 = 6,45
Z*Cl-
= Z*Cl - 0,35 = 5,75
E3
= -13,6 * 6,12 / 9 = -56,22 eV
E’3
= -13,6 * 6,452 / 9 = -62,87 eV
E’’3 = -13,6 *
5,752 / 9 = -49,96 eV
E.I = ( 6 * - 62,87 ) – ( 7 *
-56,22 ) = 16,3 eV ENDOTHERMIQUE - DIFFICILE
Efe = ( 8 * - 49,96 ) – ( 7 * -56,22 )
= -6,1 eV EXOTHERMIQUE – FACILE
XM = 0,21 * ( 16,3
+ 6,1 ) = 4,7
RCl = ( 0,215 * 9
/ 6,1) + ( 0,148 * 3 ) + 0,223 = 0,984 A°
XAR = (0,34 * 6,1
/ 0,9842) + 0,67 = 2,81
|
|
Valeur
Calculée |
Valeur
Tabulée |
|
E.I |
16,3 |
13 |
|
E.A |
6,1 |
3,62 |
|
XM |
4,7 |
3,5 |
|
R |
0,984 |
0,99 |
|
XAR |
2,81 |
2,8 |
Conclusions :
L’utilisation des règles de Slater
permet d’évaluer simplement l’ordre de grandeur de certaines propriétés
atomiques.
L’énergie d’ionisation est mieux
évaluée que l’affinité électronique. L’écart entre valeur calculée et valeur expérimentale
est toutefois assez grand. On n’obtient que l’ordre de grandeur de celles-ci.
On peut toutefois tirer des conclusions qualitatives intéressantes. Ici on voit
bien que l’ionisation «spontanée » de Cl donne Cl- (processus
exothermique libérant de l’énergie) et non Cl+ (processus
endothermique nécessitant un apport d’énergie) ce qui est tout à fait conforme
à l’expérience.
L’électronégativité de Mulliken est
assez mal évaluée en raison des erreurs sur EI et EA mais on voit tout de même que
Cl est un atome fortement électronégatif.
Le rayon atomique est par contre évalué
très correctement par la formule donnée (voir exercice suivant).
L’électronégativité d’Alred et Rochow basée sur la valeur de R est en
conséquence très correctement évaluée elle aussi.
Exercice 7
:
Pour évaluer les rayons ioniques
Pauling a supposé que ceux-ci étaient proportionnels à n2/Z* comme
les atomes neutres. D’autre part il a supposé que dans les cristaux ioniques
les anions et les cations étaient au contact et que la distance inter-nucléaire
d accessible par diffraction des rayons X était égale à la somme des rayons
ioniques de l’anion et du cation.
Dans NaF d = 2,31 A° : Evaluer les
rayons ioniques de Na et F
Dans LiF d = 2,01 A° : Evaluer les
rayons ioniques de Li et F
Comparer les valeurs obtenues pour F.
Conclusion.
Affectons l’anion de l’indice A et le
cation de l’indice C.
d = RC + RA
RC = k nC2
/ Z*C
RA
= k nA2 / Z*A
RC / RA = ( nC2
/ nA 2 ) ( Z*A / Z*C )
RC = ( nC2 /
nA 2 ) * ( Z*A / Z*C ) * RA
= K RA
D = ( K + 1 ) RA
RA
= d / ( K + 1 )
RC
= K RA
NaF : d
= 2,31 A° ; Z*C = 6,85 ; Z*A = 4,85 ; nC
= 2 ; nA = 2
K = 4,85 / 6,85 = 0,708 ; RA
= 2,31 / 1,708 = 1,35 A° ; RC = 0,708 * 1,35 = 0,96 A°
RF- = 1,35 A° ; RNa+ = 0,96 A°
LiF : d
= 2,01 A° ; Z*C = 2,70 ; Z*A = 4,85 ; nC
= 1 ; nA = 2
K=4,85 / 6,85 * 1 / 4 = 0,449 ; RA=2,01/1,449 = 1,39
A° ; RC = 0,449 * 1,39 = 0,62 A°
RF- = 1,39 A° ; RLi+ = 0,62 A°
Les valeurs trouvées pour RF-
ne sont pas tout à fait identiques mais sont tout de même très proches.
Cette méthode très simple permet donc
d’évaluer de proche en proche les valeurs des différents rayons ioniques. Une
valeur moyenne sera retenue à partir de déterminations sur plusieurs solides
ioniques différents. Ces valeurs des rayons ioniques de Pauling ont été
tabulées et sont largement utilisées en cristallographie.
D’autres tables plus modernes existent,
telle que la table de Schanon et Prewitt qui ont corrélés les distances internucléaires
de plus de mille oxydes. En pratiques les différences sont faibles entre les
diverses tables et la table de Pauling est encore très utilisée actuellement.
Exercice 8:
Soit 4 éléments X, Y, Z et W.
On sait que ces 4 éléments sont situés dans
les 3 premières lignes de la classification périodique.
On donne les 6 premières énergies
d’ionisation (en eV) de ces quatre éléments.
On donne d’autre part une
représentation graphique de la variation de ces énergies d’ionisation.
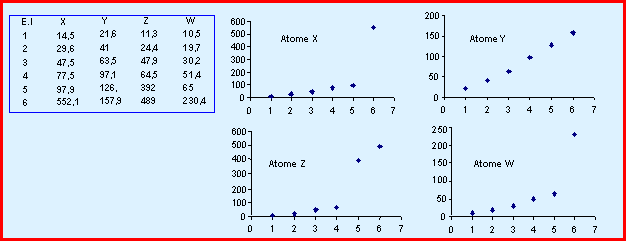
1) Pour trois de ces éléments (X,Z et W) il est facile d'identifier à quelle colonne de la classification périodique ils appartiennent. Attribuer sa colonne à chacun en justifiant votre réponse.
2) Pour un de ces éléments (Y) il est difficile d'identifier la colonne. Des mesures de magnétisme permettent de déterminer que cet atome Y ne possède aucun électron célibataire. Identifiez la colonne d'appartenance de cet élément grâce à ce renseignement supplémentaire.
3) Deux de ces éléments (X et W) appartiennent à un même groupe de la classification, comment cela se traduit-il sur la représentation graphique ? Justifiez. Attribuer à ces deux atomes leur symbole et leur nom en justifiant votre réponse.
4) Elément Y :
Quelles sont les diverses possibilités pour cet élément ? Pour lever
l’indétermination calculer l’énergie de cinquième ionisation pour les deux
possibilités et comparer les résultats obtenus à la valeur expérimentale.
Conclure sur la nature de Y.
5) Elément Z :
Quelles sont les diverses possibilités pour cet élément ? Identifiez cet
élément sachant que son électronégativité est de 2,5 dans l’échelle d’Alred et
Rochow.
CORRIGE
1) Pour trois de ces
éléments (X,Z et W) il est facile d'identifier à quelle colonne de la classification
périodique ils appartiennent. Attribuer sa colonne à chacun en justifiant votre
réponse.
On arrache
successivement les électrons de l'atome pour obtenir les ions correspondants,
quand l'ion obtenu possède la structure électronique d'un gaz rare il est
particulièrement stable (règle de l'octet) et il sera donc très difficile de lui arracher un nouvel
électron.
Cela se
manifeste par une brusque augmentation de l'énergie d'ionisation visible par un
"saut" sur le graphique.
La position du
"saut" permet donc d'identifier le groupe auquel appartient
l'élément.
Elément X : Le saut se produit entre la 5ème et la 6ème
ionisation, l'ion X5+ est donc très stable et possède la structure
d'un gaz rare. L'élément X appartient donc à la colonne 15 de la classification
périodique.
Elément Z : Le saut se produit entre la 4ème et la 5ème
ionisation, l'ion Z4+ est donc très stable et possède la structure
d'un gaz rare. L'élément Z appartient donc à la colonne 14 de la classification
périodique.
Elément W : Le saut se produit entre la 5ème et la 6ème
ionisation, l'ion W5+ est donc très stable et possède la structure
d'un gaz rare. L'élément W appartient donc à la colonne 15 de la classification
périodique.
2) Pour un de ces éléments (Y)
il est difficile d'identifier la colonne. Des mesures de magnétisme permettent
de déterminer que cet atome Y ne possède aucun électron célibataire. Identifiez
la colonne d'appartenance de cet élément grâce à ce renseignement
supplémentaire.
Le saut n'est pas visible
sur le graphique, il doit donc se produire après la 6ème ionisation.
L'élément Y doit donc appartenir aux
colonnes 16, 17 ou 18.
Les configurations
électroniques correspondantes sont :
Colonne 16 : s2 p4 - 2 électrons célibataires
Colonne 17 : s2 p5 - 1 électron célibataire
Colonne 18 : s2 p6 - pas d'électrons célibataires
L'élément Y est
donc un gaz rare de la colonne 18.
3) Deux de ces éléments (X et W) appartiennent à un même groupe de la
classification, comment cela se traduit-il sur la représentation graphique ?
Justifiez. Attribuer à ces deux atomes leur symbole et leur nom en justifiant
votre réponse.
On observe un parallélisme
évident entre les deux représentations graphiques.
Les éléments d'un même
groupe possèdent des configurations électroniques du même type et donc des
propriétés voisines. L'évolution de leurs énergies d'ionisation successives est
donc semblable.
Les énergies d'ionisation de
X sont toujours supérieures à celles de W.
L'énergie d'ionisation
augmente de Gauche à Droite et de Bas en Haut dans la classification
périodique. X et W appartiennent au même groupe, X est donc placé plus haut que
W.
X est donc l'Azote (N) et W le Phosphore (P).
4)
Elément Y : Quelles sont les diverses possibilités pour cet
élément ? Pour lever l’indétermination calculer l’énergie de cinquième
ionisation pour les deux possibilités et comparer les résultats obtenus à la
valeur expérimentale. Conclure sur la nature de Y.
Y est un gaz rare.
Y est donc soit l'Hélium He,
soit le Néon Ne, soit l'Argon Ar.
On donne les 6 première énergie d'ionisation de Y, l'Hélium ( Z = 2
) est donc exclu.
L'énergie de 5ème ionisation correspond au passage de A4+ à A5+.
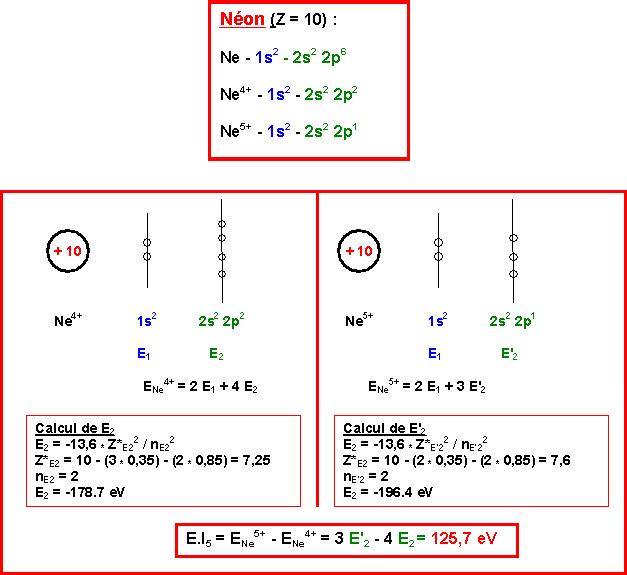
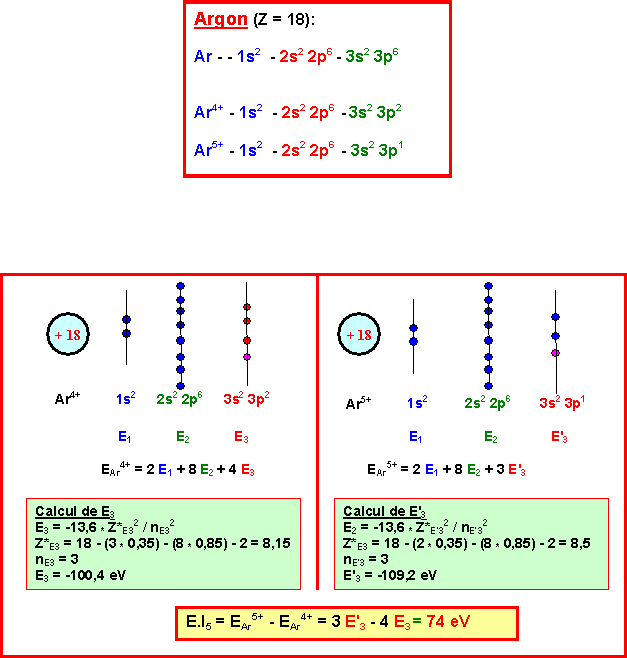
La
valeur expérimentale pour l'atome Y est de E.I5 = 126,2 eV.
L'élément Y est donc le Néon Ne.
5)
Elément Z : Quelles sont les diverses possibilités pour cet
élément ?
Identifiez cet élément
sachant que son électronégativité est de 2,5 dans l’échelle d’Alred et Rochow.
Rayon de covalence des atomes : RCov (A°) = 0,215 n2 / Z* + 0,145 n +
0,225
Electronégativité d'Alred et Rochow : XA.R = 0,34 [ Z* / RCov2 ] +
0,67 (Rcov en A°)
L'élément Z appartenant à la colonne 14 peut être le Carbone ou le
Silicium.
Cas du Carbone C :
C : Z = 6 - 1s2
2s2 2p2
Z* = 6 - ( 3 * 0.35 ) - (2 *
0,85 ) = 3,25
R = 0,7796 A°
X
= 2,49
Cas du Silicium
Si : Z = 14 - 1s2 2s2 2p6
3s2 3p2
Z* = 14 - ( 3 * 0.35 ) - (8 *
0,85 ) - 2 = 4,15
R = 1,126 A°
X
= 1,8
Z est donc le Carbone
C.