Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
UNIVERSITE DE LA REUNION ANNEE UNIVERSITAIRE 2002-2003
TRAVAUX DIRIGES D'INITIATION A LA CHIMIE THEORIQUE-ATOMISTIQUE
T.BRIERE
DEUXIEME PARTIE : LES MOLECULES
SERIE 5 - MODELE DE LEWIS - GEOMETRIE DES MOLECULES - MESOMERIE
Exercice 1
Le chlore donne avec l'oxygène des ions de formules : ClO-, ClO2-, ClO3-, ClO4-
Pour chacun établir le schéma de Lewis moléculaire coorrespondant, écrire les formes mésomères principales, et décrire par un schéma l'hybride de résonance correspondant à la molécule réelle.
Exercice 2 :
Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
AlCl3 ; SO2 ; PO43- ; CO32- ; H3 O+ , NO2- ; NO2+ , XeF4 , XeO3
Exercice 3 :
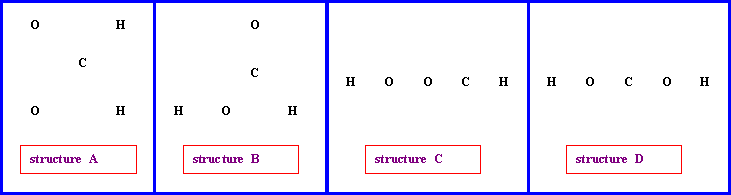
Soit la molécule de formule brute CH2O2 :
On peut envisager (entre autres) les enchaînements d’atomes suivants pour cette molécule

1) Proposer pour chacun de ces enchaînements une structure de Lewis moléculaire.
On fera apparaître les divers types de liaisons (simples, doubles ou triples) ainsi que les éventuels doublets libres et/ou cases quantiques vides.
2) Donner dans chaque cas la géométrie prévue par la méthode V.S.E.P.R. On précisera la valeur prévue pour les divers angles de liaison.
3) A partir des valeurs des rayons de covalence des atomes C, H et O on estimera les diverses longueurs de liaisons dans chaque cas (formules données plus haut)
4) Cette molécule existe réellement, il s’agit de l’acide méthanoïque (ou formique) HCOOH (structure B) et on a pu déterminer expérimentalement les diverses longueurs de liaisons ainsi que les divers angles de liaisons. On a trouvé les résultats suivants :
Longueurs des liaisons ( A°) : 0,95 - 1,09 - 1,25 - 1,31
Angles de liaisons ( °) : 108 - 118 - 118 - 124
a) Attribuer les diverses longueurs de liaisons observées.
b) Pour une des liaisons l’accord entre valeur calculée et expérimentale est nettement moins bon que pour les autres. De quelle liaison s’agit-il ? Montrer qu’il est possible d’expliquer ce mauvais accord par l’existence d’une forme mésomère faisant intervenir un des doublet libres de l’atome d’oxygène.
Montrer d’autre part que l’intervention de cette forme mésomère permet d’expliquer l’acidité importante (pKa=3,7) de l’acide formique.
Montrer de même que l’anion formiate HCOO- dont on donnera la structure de Lewis est fortement stabilisé par effet mésomère.
c) Attribuer les divers angles de liaison observés.
Exercice 4 : L'Acide Nitrique HNO3
La figure suivante donne la géométrie de la molécule d'acide nitrique à l'état gazeux.
La molécule est plane dans ces conditions.
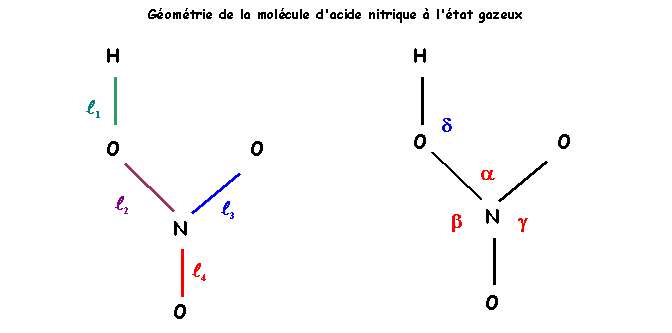
La détermination expérimentale des longueurs de liaisons a donné les résultats suivants en phase gazeuse :
Longueurs des liaisons en A° : 0,96 - 1,21 - 1,21 - 1,41
Liaison |
l1 (OH) |
l2 (NO) |
l3 (NO) |
l4 (NO) |
Longueur calculée (A°) |
||||
Longueur expérimentale (A°) |
7) Quelle valeur prévoit-on pour l'angle NOH dans ce modèle ?
La détermination expérimentale des angles de liaisons a donné les résultats suivants en phase gazeuse :
8) Quel est l'angle qui vaut 102° ? Comparer avec sa valeur prévue par la méthode R.P.E.C.V. Justifier l'écart éventuel.
9) Les trois angles ONO ne sont pas identiques, l'un est nettement supérieur aux deux autres.
b) Pourquoi cet angle est-il plus grand que les deux autres ?
c) Les deux autres angles sont très proches l'un de l'autre avec une différence de 2° seulement. Essayer de justifier cette petite différence.
Exercice 5 : L'ion Azoture N3-
L’ion azoture N3- , bien que très instable, existe. Il est utilisé dans les airbags, sous le choc N3- se décompose en N2 qui gonfle l'airbag. Cet ion possède une géométrie linéaire, les deux liaisons NN sont identiques et de longueur 1,15 A°. Les trois atomes d'azote obéissent de plus à la règle de l'octet. Montrer que ces faits expérimentaux s'expliquent par l'interventions de plusieurs formes mésomères que l'on précisera. On donnera une représentation symbolique de l'hybride de résonance et on justifiera la géométrie linéaire et la longueur de liaison expérimentale.
SERIE 6 : LIAISONS POLARISEES - MOMENT DIPOLAIRES - LIAISONS HYDROGENE
Exercice 1 :
Soient les énergies de dissociation suivantes en kJ mol-1
H2 435 ; F2 155 ; Cl2 242 ; HF 566 ; HCl 431
Déterminer les électronégativités selon Pauling des atomes F et Cl.
On prendra k = 2,2 pour H.
Exercice 2 :
Calculer les pourcentages ioniques des liaisons suivantes :
H ---- Cl m = 1,08 D d = 1,27 A°
H ---- Br m = 0,79 D d = 1,42 A°
H ---- I m = 0,38 D d = 1,61 A° (1 D = 0,333 10-29 C . m)
Exercice 3 :
La molécule SO2 a une géométrie en V ; l’angle des deux liaisons S-O est de 119°. Son moment dipolaire mesuré est de 1,65 D (1 D = 0,333 10-29 C . m). Donner la structure de Lewis de cette molécule. Montrer qu’on peut la décrire par deux structures mésomères obtenues soit en " excitant " S, soit en " excitant " O. La longueur de liaison expérimentale est de 1,43 A°. Comparer à la valeur calculée. Conclusion ? Calculer le pourcentage d’ionicité de ces liaisons. Calculer les charges partielles portées par chaque atome.
Exercice 4 :
Sachant que le moment dipolaire partiel de liaison mN-O est de 0,15 D :
a) calculer le moment dipolaire global de l’ion NO3-.
b) calculer le moment dipolaire global de la molécule NO2 (a = 134°).
Exercice 5 :
Le moment dipolaire du mono-sulfure de carbone CS est de 1,98 D et la longueur de liaison est de 1,53 A°.
a) Vérifier par le calcul la longueur de liaison expérimentale
b) Calculer la charge partielle portée par chaque atome.
c) Calculer le caractère ionique partiel de la liaison C- S .
Exercice 6 :
Quel moment dipolaire peut on attribuer au chloroforme CHCl3 sachant que les moments partiels de liaisons sont mCH = 0,4 D et mCCl = 1,5 D
Exercice 7
La molécule d'eau possède un moment dipolaire global m H2O = 1,845 D.
L’angle des liaisons O-H dans la molécule d’eau étant de 104,5 ° et la longueur de la liaison O - H de 0,95 A°.
Exercice 8 : Acide maléïque et acide fumarique
Ces deux composés isomères ont la même formule brute C4H4O4 et présentent les structures suivantes :
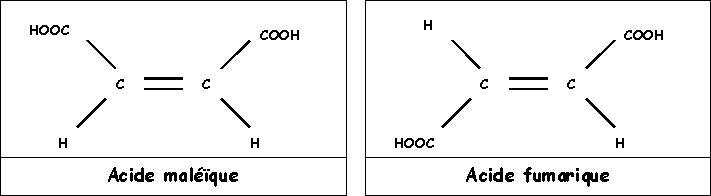
1) En supposant que le groupement COOH soit très électronégatif (et donc plus électronégatif que C) et en négligeant la polarité des liaisons C - H, montrer qualitativement que les moments dipolaires globaux des deux isomères doivent être très différents l'un de l'autre. Quel est l'isomère possédant le moment dipolaire le plus élevé? Quel est l'isomère possédant le moment dipolaire le plus faible?
2) Solubilité dans l'eau des acides maleïque et fumarique
Sachant que les molécules polaires sont très solubles dans les solvant polaires alors que les substances peu polaires le sont beaucoup moins, prévoir lequel des deux acides maleïque ou fumarique est le plus soluble dans l'eau.
3) Point de fusion des acides maleïque et fumarique
L'un de ces deux acides possède un point de fusion de 130°C et l'autre un point de fusion de 226°C. Justifiez cette forte différence et attribuez son point de fusion à chaque isomère.
4) Constantes d'acidité des acides maleïque et fumarique
L'un des deux isomères possède les pKa suivants : pK1 = 3 et pK2 = 4,4
L'autre isomère possède les pKa suivants : pK1 = 1,9 et pK2 = 6,2
On voit que l'un des deux composés possède simultanément le pK1 le plus petit et le pK2 le plus grand. Justifier ce fait expérimental par un/des schéma(s).
Attribuer a chaque isomère les valeurs de ces deux pKa.
SERIE 7 : Quelques notions quantiques - Ondes de de Broglie - Principe d’Heisenberg - Equation de Schröeninger -
Exercice 1 :
1) Retrouver la forme de l'équation de Schröeninger :
F" + ( 8 P2 m / h2) ( E - V ) F = 0
En partant de l'équation d'une onde stationnaire dans un espace à une dimension de la forme :
f = A Sin (2 p x / l ) Cos ( 2 p n t)
Cette équation est obtenue en mécanique classique pour la vibration d'une corde entre deux bornes. En mécanique quantique elle correspond au cas simple d'un électron " dans une boite à une dimension " c'est à dire se déplaçant en ligne droite entre deux points. On dérivera deux fois la fonction d'onde par rapport à x puis on introduira la formule de De Broglie dans le cas de l'électron. On exprimera l en fonction de l'énergie cinétique de l'électron. On exprimera ensuite EC en fonction de ET et EP.
2) Chercher à partir de l'expression de la fonction d'onde les valeurs propres de l'énergie pour un électron se déplaçant en ligne droite entre deux points. Pour cela on introduira la condition de quantification correspondant au fait que la fonction d'onde s'annule pour les deux bornes. On exprimera cette condition par analogie avec une corde vibrante. On supposera pour simplifier le problème que l'électron est dans un puis de potentiel, c'est à dire que le potentiel est nul à l'intérieur de la "boite à une dimension" et infini à l'extérieur.
3) Sur un schéma on représentera les valeurs propres de l'énergie en fonction du nombre quantique principal ainsi que l'allure de variation de la fonction d'onde correspondante pour les trois premières valeurs de n. Enfin on représentera la variation du carré de la fonction d'onde. A quoi correspond cette dernière ?
On précisera le signe de la fonction d'onde, le nombre de lobes et le nombre de noeuds.
Exercice 2 :
Calculer les longueurs d'onde associées aux systèmes matériels suivants :
a) balle de revolver de 2 g lancée à 300 m/s
b) voiture de 2 t à 100 km/h
c) électron se déplaçant à 3 104 m/s
Exercice 3 :
Exprimer le caractère ondulatoire d'un électron sur une orbite de Bohr et retrouver la condition de quantification du moment cinétique.
Exercice 4 :
a) Si l'on suppose que le rayon de l'orbite de Bohr a0 = 0,529 A° est connu à 1% près, calculer DV incertitude sur la vitesse de l'électron de masse 9,1 10-31Kg. Conclusion ?
b) Si l'on suppose que la position d'une bille de masse 1 g est connue au mm près, quelle est l'incertitude sur sa vitesse ? Conclusion ?
c) Un automobiliste féru de mécanique quantique à été pris par un radar à 120 Km/h au volant de sa voiture de 1500 Kg. Il invoque le principe d'incertitude d'Heisenberg pour contester le P.V. A-t-il raison ?
SERIE 8 : Recouvrement et Hybridation des Orbitales Atomiques - Orbitales Moléculaires - Modèle C.L.O.A - O.M - Mesomérie
Exercice 1 :
Pour l’atome de Carbone et l’atome d’Hydrogène donner la configuration électronique dans leur état fondamental. Représenter leur couche de valence avec le modèle des cases quantiques.
Représenter la " forme géométrique " de leurs orbitales atomiques de valence.
Quel composé devrait se former entre ces deux atomes si on considérait simplement le recouvrement de leurs orbitales atomiques de valence dans leur état fondamental?
En réalité ce composé n’existe pas. Le composé le plus simple de ces deux atomes est le méthane de formule CH4. Expliquer la formation de ce composé. Quelle géométrie devrait avoir ce composé si on considérait simplement le recouvrement des orbitales atomiques de valence de C et H ?
Quelle est la géométrie réelle du méthane ? Quel type d’hybridation permet de le décrire correctement ?
Exercice 2 :
Décrire la géométrie, l’hybridation des atomes de carbone et les liaisons dans les molécules suivantes : CH2=CH2 , HCOOH , HCHO , CH2 =C=CH2
Exercice 3 :
Dans les structures suivantes dénombrer les doublets liants s ou p, les doublets non liants n, et les cases vides présents dans les couches de valence.
AlF4- - CCl2 - SiO2 - CH3-CH2+ - CH2=CH-CH=O - COCl2
Exercice 4 :
On s’intéresse aux molécules O2 et S2.
a) Donner un diagramme décrivant la molécule de dioxygène en utilisant l’approximation C.L.O.A (Combinaison Linéaire d’Orbitales Atomiques)
b) Cette molécule est-elle Paramagnétique ou Diamagnétique ? Pourquoi ?
c) Cela était-il prévisible par la théorie de Lewis ? Pourquoi ?
d) Pour la molécule S2 et les ions moléculaires correspondants ( S2+ ; S22+ ; S2- ; S22-) on trouve les résultats suivants pour les distances de liaisons S-S :
d S-S (A°) 1,72 1,79 1,88 2 2,20
Attribuer à chaque espèce sa longueur de liaison.
Exercice 5: Le Diazote N2
Décrire la molécule de diazote N2 dans le modèle C.L.O.A - OM. On précisera l'indice de liaison et on indiquera si ce composé est paramagnétique ou diamagnétique ?
Exercice 6 :
On donne les énergies des orbitales atomiques des atomes de carbone et d’oxygène exprimées en eV.
Carbone : 1s (-307 eV) ; 2s (-19 eV) ; 2p (-11,7 eV)
Oxygène : 1s (-560 eV) ; 2s (-33,7 eV) ; 2p (-17,1 eV)
1) Molécules C2 et O2
a) Construire sur un même graphique les diagrammes énergétiques de C et O.
b) Pour une de ces molécules il y a une forte interaction sp. Laquelle ?
c) L’interaction sp est négligeable pour l’autre. Laquelle ?
d) Construire le diagramme des Orbitales moléculaires de C2 et de O2.
e) Ces deux molécules peuvent donner chacune un cation et un anion. Quand on observe les longueurs de liaisons on trouve :
dO2- > dO2 > dO2+ et dC2+ > dC2 > dC2-
Justifier ces résultats.
f) Dans la série O2 , O2+ et O2- quelle est la molécule dont l’énergie de dissociation est la plus élevée? Pourquoi?
2) Molécule CO
On donne les énergies des O.M de CO en eV :
-560 (1 s) ; -307 (2 s) ; -40,5 (3 s) ; -19,9 ( 4 s) ; -15,8 (1 p) ; -13,5 (5 s) ; 7,1 (2 p) ; 25,3 (6 s)
a) Construire le diagramme des O.M correspondant.
b) Quand on passe de CO à CO+, la distance de liaison ne varie pratiquement pas. Justifiez ce résultat expérimental.
Exercice 7 :
La molécule de monoxyde d’azote NO est paramagnétique.
Exercice 8 : La molécule d'éthylène C2H2
a) Expliquer grâce à un schéma clair la formation des liaisons dans la molécule d'éthylène par recouvrement d'orbitales atomiques hybrides dont on précisera la nature. Indiquez le type (s ou p) des liaisons obtenues.
b) Expliquer pourquoi si l'on substitue deux hydrogènes (situés sur deux carbones différents) par un groupe quelconque X il existe deux isomères bien distincts.
Exercice 9 :
On s’intéresse à la géométrie de la molécule de prop-2-énal : CH2 = CH - CHO
a) en appliquant la méthode V.S.E.P.R donner la géométrie autour de chaque carbone. Peut-on prévoir la géométrie globale de la molécule ?
b) L’expérience montre que la molécule est plane. Représenter le système p et justifier ce fait expérimental.
c) Que peut-on prévoir pour les longueurs de liaison C-C ?
Exercice 10 :
Donner les diverses formes limites de résonance des composés suivants :
Benzène C6H6- Nitrobenzène C6H5NO2- Aniline C6H5NH2 - Chlorobenzène C6H5Cl
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com