Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
SERIE 5 - MODELE DE LEWIS - GEOMETRIE DES MOLECULES - MESOMERIE
Exercice 1
Le chlore donne avec l'oxygène des ions de formules : ClO-, ClO2-, ClO3-, ClO4-
Pour chacun établir le schéma de Lewis moléculaire correspondant, écrire les formes mésomères principales, et décrire par un schéma l'hybride de résonance correspondant à la molécule réelle.
On suppose que O est légèrement plus électronégatif que Cl (échelle de Pauling).
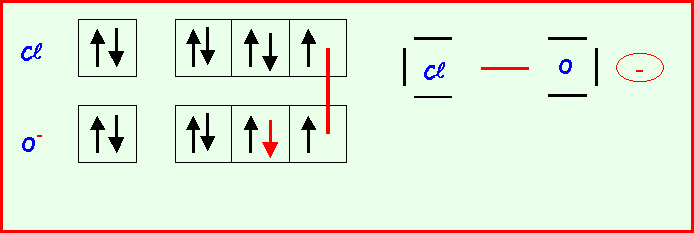
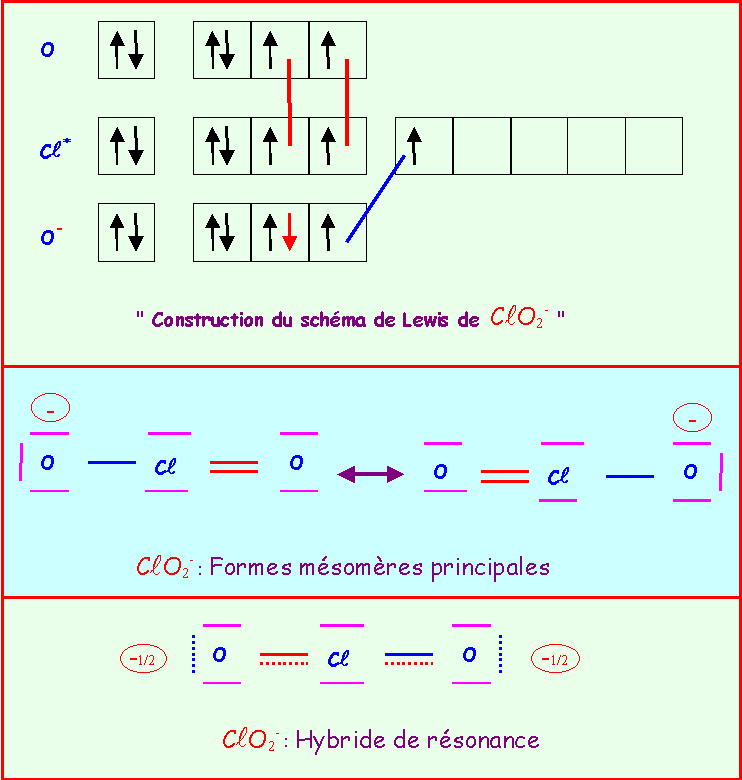
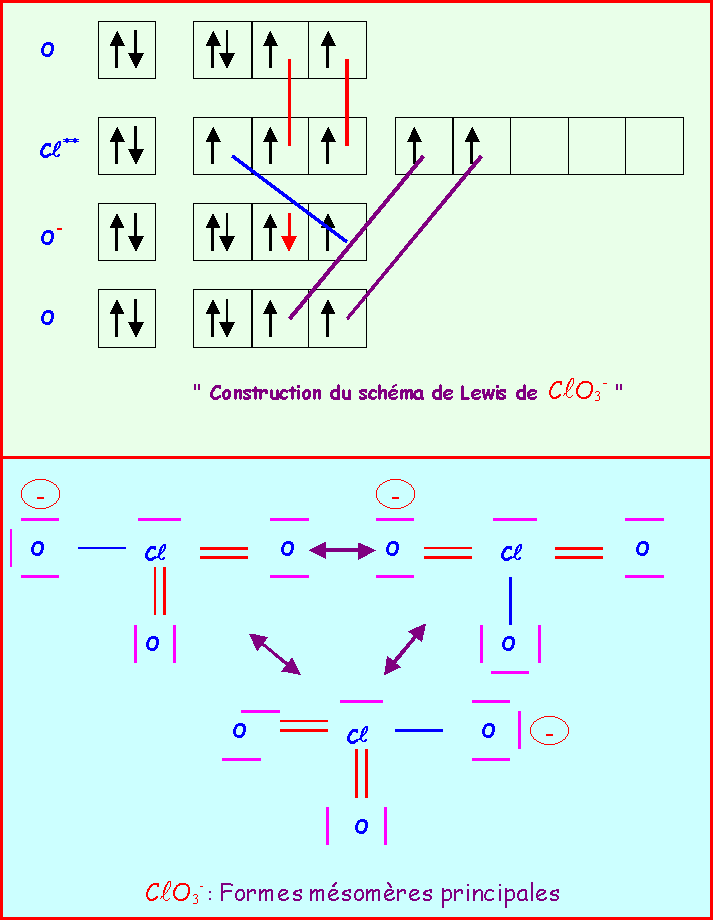
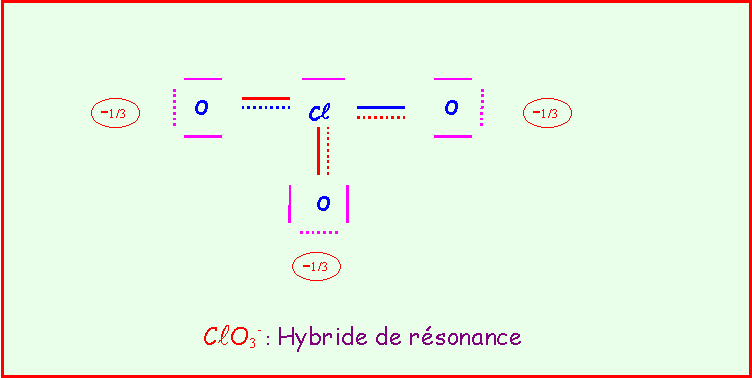
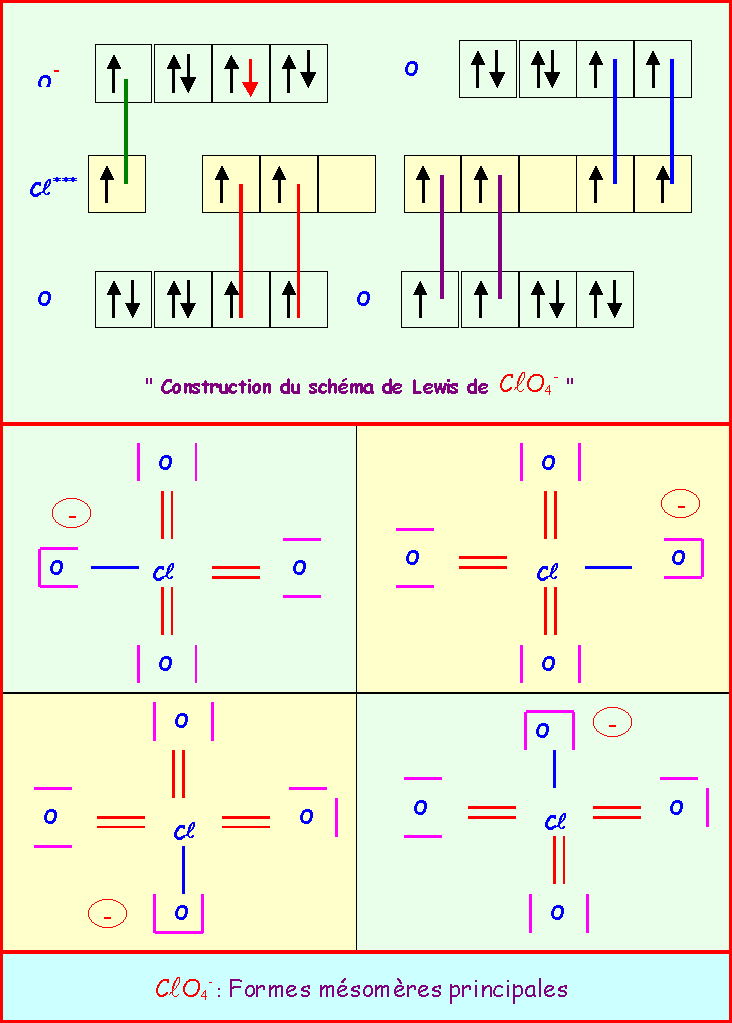
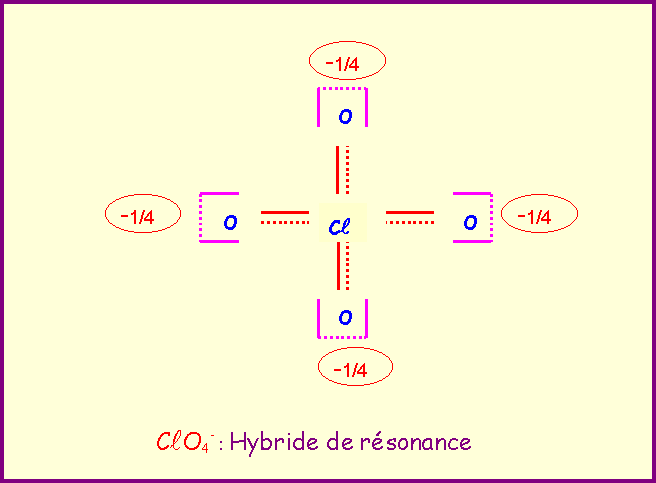
Exercice 2 :
Pour les molécules ou ions suivants :
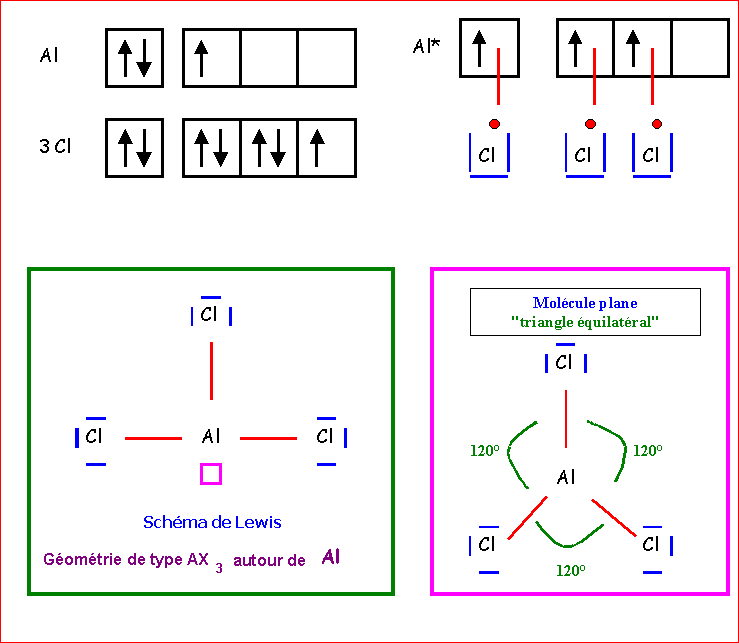
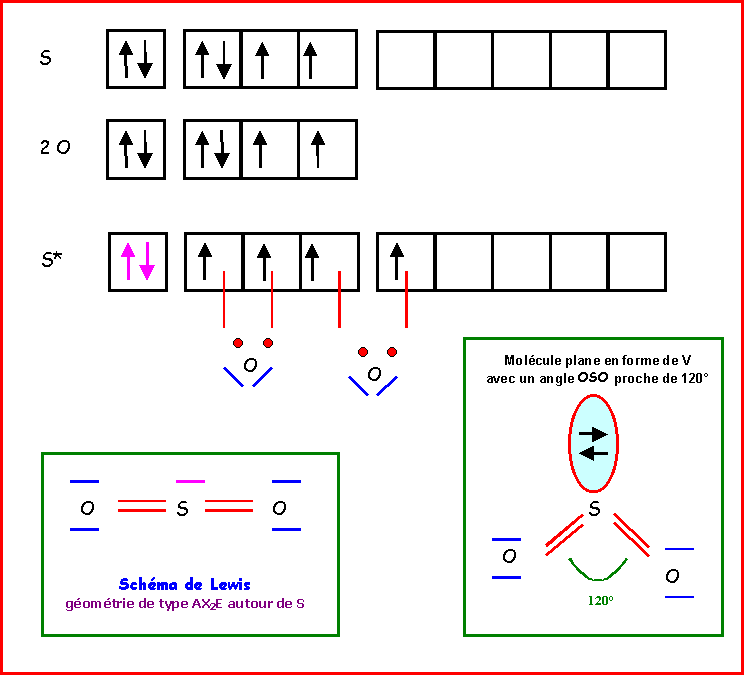
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
AlCl3 ; SO2 ; PO43-
; CO32- ; H3 O+ , NO2-
; NO2+ , XeF4 , XeO3
AlCl3
SO2
PO43-
Nous allons utiliser la "méthode rapide".
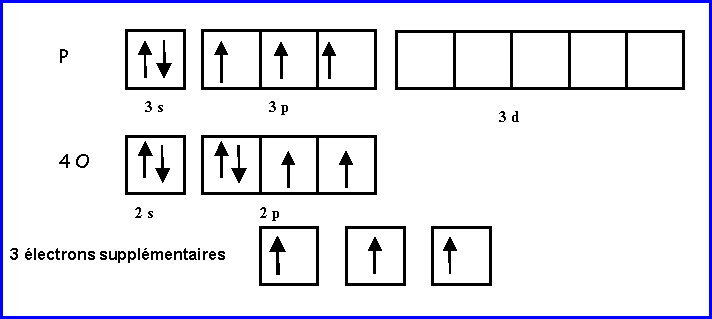
Les atomes latéraux O sont supposés faire des doubles liaisons puisqu'ils possèdent 2 électrons célibataires.
L'atome central P possède 5 électrons et on lui attribue de plus les 3 électrons supplémentaires soit 8 électrons au total.
Il utilise ses 8 électrons pour faire 4 doubles liaisons avec les 4 atomes d'oxygène et ne possédera donc pas de doublets libres.
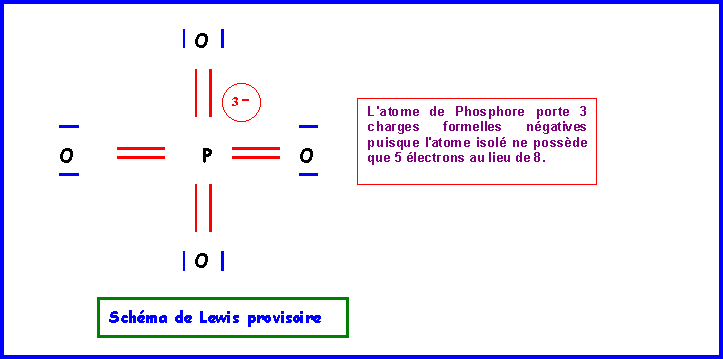
Sur cette base on peut facilement déduire un schéma de Lewis provisoire.
Cette première structure ne présenta pas d'impossibilités puisque qu'avec ses 9 cases quantiques ( 3s , 3p, 3d ) il peut théoriquement former jusqu'à 9 liaisons. Néanmoins cette forme possède deux grands défauts qu'il convient de corriger :
- 3 charges sur un même atome
- électronégativité non respectée puisque O est plus électronégatif que P.
Echelle de Pauling : XO = 3,44 - XP = 2,12
Le remède consiste à "rabattre" les doublets vers l'atome d'oxygène.
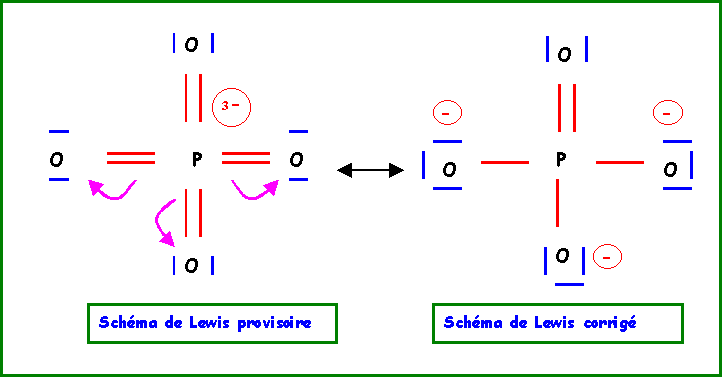
Cette forme mésomère de haut poids statistique existe en fait sous 4 formes totalement équivalentes en permutant les rôles des quatre atomes d'Oxygène. La molécule réelle sera un hybride de résonance entre ses 4 formes.
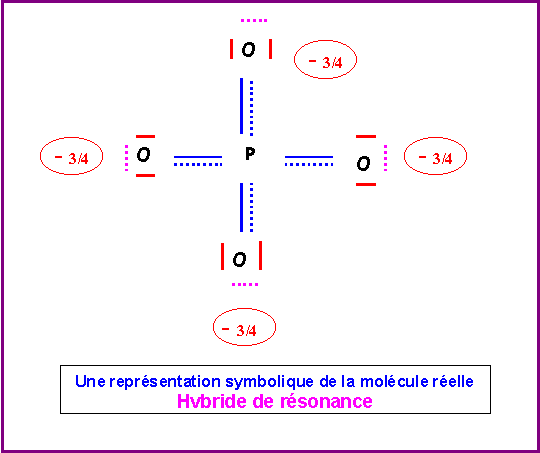
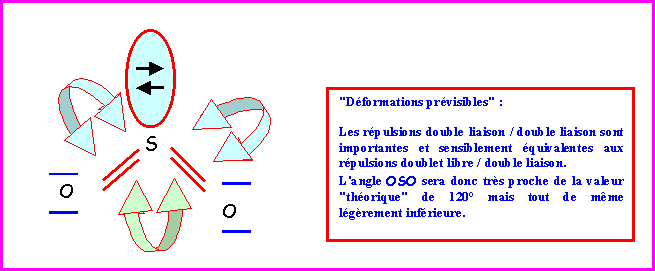
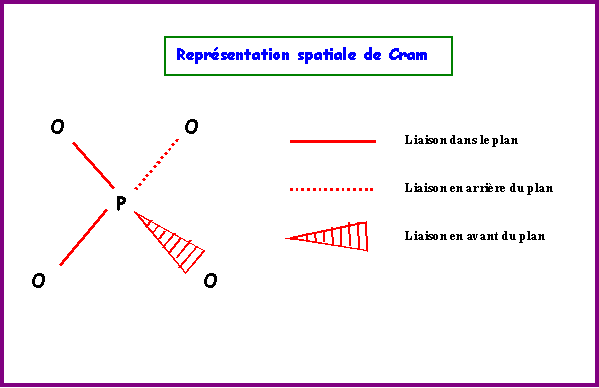
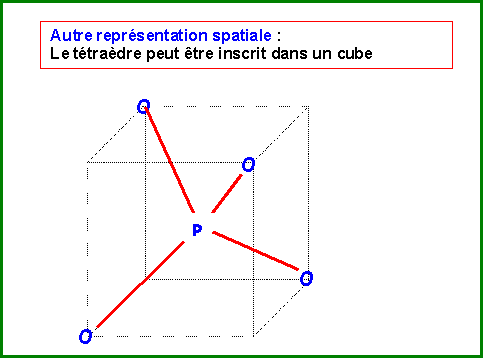
La molécules réelle est parfaitement symétrique avec une géométrie de type AX4 autour de l'atome de Phosphore central.
La molécule est donc de forme tétraédrique avec des angles OPO de 109,5°.
CO32-
Méthode rapide :
C central : 4 électrons + 2 électrons de charge = 6 électrons
3 O latéraux * 2 électrons célibataires => 3 doubles liaisons => 6 liaisons pour C
6 électrons et 6 liaisons => C ne possède pas de doublets libres.
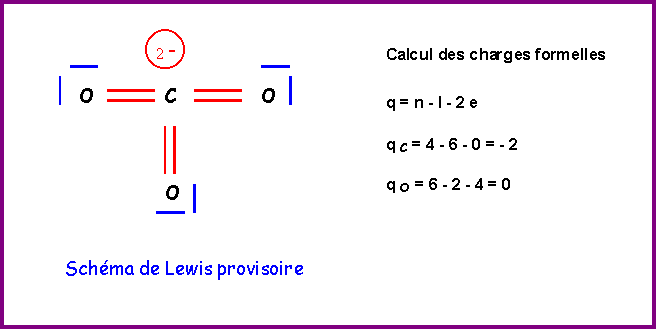
Ce schéma provisoire présente plusieurs gros défauts :
- C élément de la deuxième période présente 6 liaisons ce qui est impossible
- 2 charges sont présentes sur un même atome.
- L'électronégativité n'est pas respectée (XO > XC)
Pour le corriger, il suffira de "rabattre" les doublets vers les atomes d'Oxygène
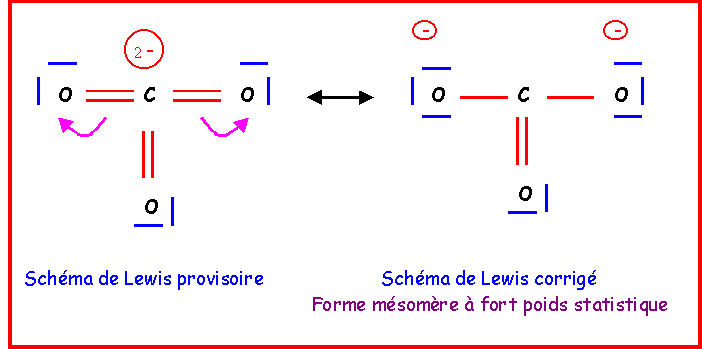
Cette forme existe en réalité sous trois formes mésomères totalement équivalentes en échangeant simplement le rôle des oxygènes.
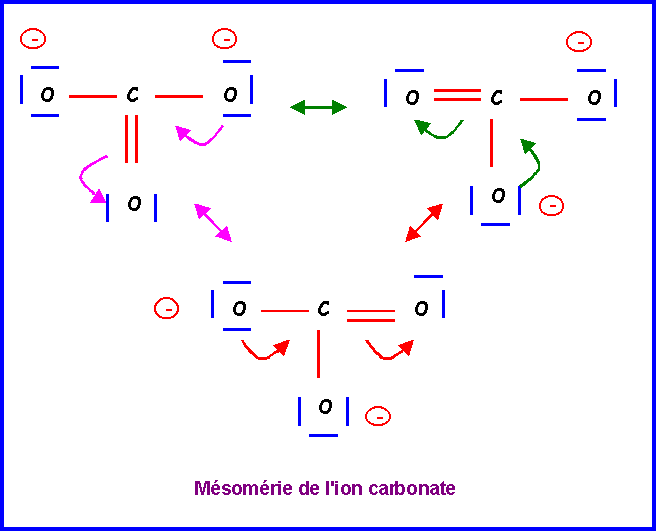
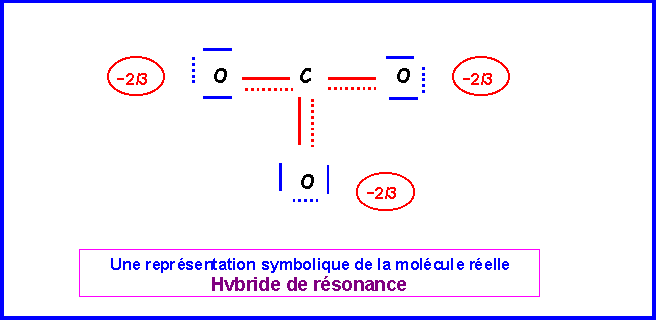
La molécules est du type AX3 avec une symétrie parfaite. Triangle équilatéral plan avec des angles de 120 ° exactement. Les trois liaisons sont identiques et intermédiaires entre la simple et la double liaison.
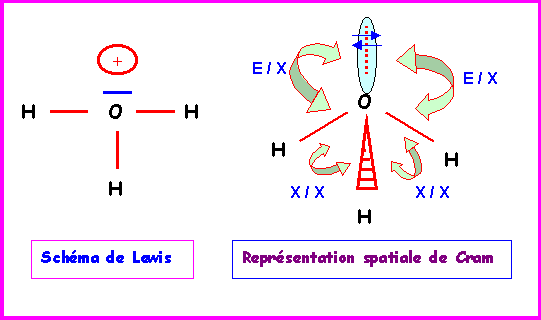
H3O+
Méthode rapide :
O central : 6 électrons.
On enlève 1 électron a cause de la charge positive soit 5 électrons.
H latéral possède 1 électron célibataire et fait donc 1 liaison simple avec O.
O central fait donc 3 liaisons avec les 3 H et il lui reste donc 5 - 3 = 2 électrons soit 1 doublet libre. On obtient alors le schéma de Lewis provisoire suivant :

Cette forme provisoire présente le défaut apparent de faire porter une charge positive sur l'atome le plus électronégatif. Il n'est pas possible de le corriger en déplaçant un doublet de liaison de H vers O car la liaison covalente serait brisée pour donner H2O et H+. En effet, H ne possède pas de doublet libre qui pourrait se déplacer simultanément pour compenser.
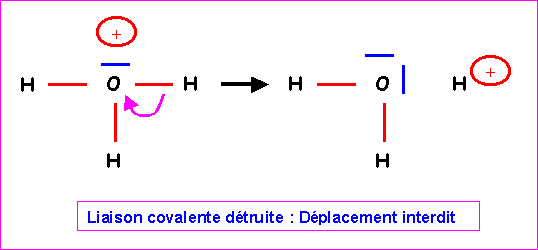
Finalement le schéma de Lewis obtenu est donc le bon.
La géométrie autour de l'atome central est du type AX3E.
On aura donc affaire à un tétraèdre auquel il manquera un sommet. Soit finalement à une structure pyramidale à base triangulaire avec des angles HOH proches de 109°.
En raison des répulsions doublet libre / doublet de liaison ( E / X ) plus importante que les répulsions doublet de liaison / doublet de liaison ( X / X ) l'angle HOH sera en réalité légèrement inférieur a 109°.
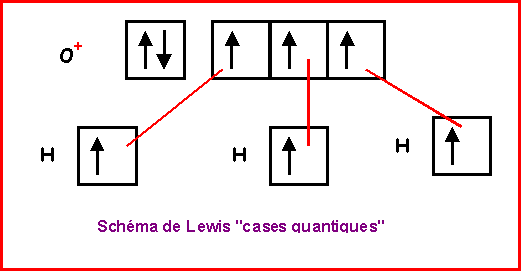
NO2-
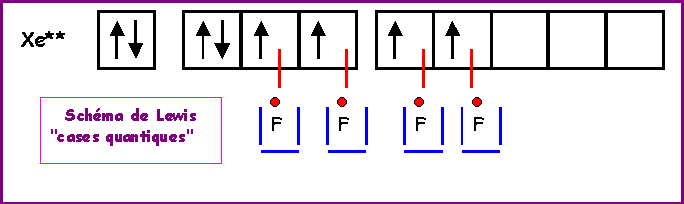
Nous allons ici pour changer utiliser la technique des cases quantiques.
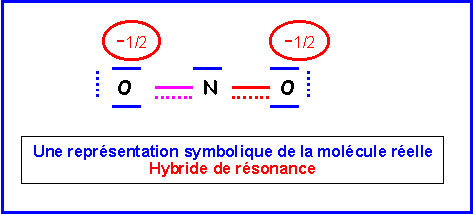
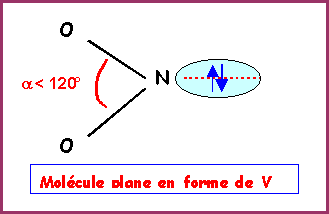
La molécule présente une géométrie de type AX2E autour de l'atome d'azote central.
On aura donc affaire à un triangle équilatéral amputé d'un sommet soit une molécule en forme de V avec un angle ONO légèrement inférieur à 120° a cause des répulsions "doublet libre / doublet de liaison" plus importantes que les répulsions "doublet de liaison / doublet de liaison".
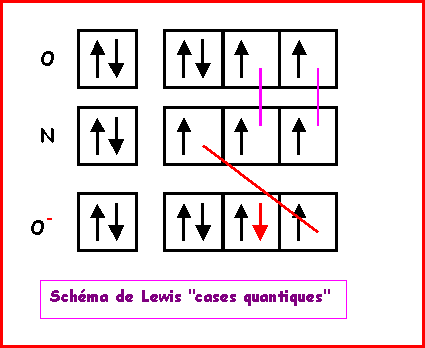
NO2+
Nous allons ici aussi utiliser la technique des cases quantiques.

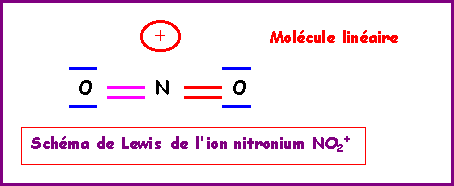
La molécule présente une géométrie de type AX2 autour de l'atome d'azote central soit une molécule linéaire.
XeO3
Méthode rapide :
L'atome central Xe possède 8 électrons de valence.
L'atome latéral O possède 2 électrons célibataire et forme donc une double liaison.
Xe forme donc 6 liaisons avec les 3 O et il lui reste donc 8 - 6 = 2 électrons soit 1 doublet libre.
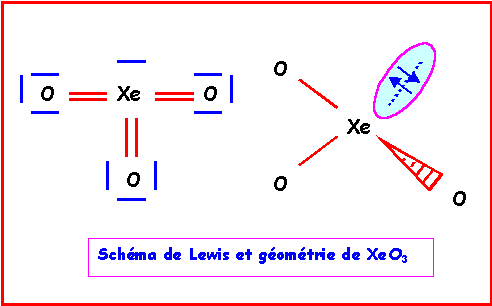
Comme pour H3O+, la géométrie est du type AX3E autour de l'atome central.
On a donc affaire à un tétraèdre amputé d'un sommet.
Les angles OXeO sont légèrement inférieur à 109°, la molécule est en forme de pyramide à base triangulaire.
Remarque : Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc que très difficilement des composés chimiques stables, et ce n'est qu'en 1962 qu'on réussit à synthétiser de tels composés. C'est la grande réactivité de l'Oxygène et notamment sa forte électronégativité qui expliquent que XeO3 existe. Les liaisons sont formées en utilisant les cases 5 d vides du Xénon.
XeF4
Méthode rapide :
L'atome central Xe possède 8 électrons de valence.
L'atome latéral F possède 1 électron célibataire et forme donc une simple liaison.
Xe forme donc 4 liaisons avec les 4 F et il lui reste donc 8 - 4 = 4 électrons soit 2 doublets libres.
La géométrie est du type AX4E2 autour de l'atome central.
On a donc affaire à un octaèdre amputé de 2 sommets.
Comme les répulsions doublet libre doublet libre sont les plus importantes, les 2 doublets libres se placent à l'opposé l'un de l'autre et la molécule a la forme d'un carré. Les angles FXeF sont tous de 90°, la molécule est plane.
Remarque : Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc que très difficilement des composés chimiques stables, et ce n'est qu'en 1962 qu'on réussit à synthétiser de tels composés. C'est la grande réactivité du Fluor et notamment sa forte électronégativité qui expliquent que XeF4 existe. Les liaisons sont formées en utilisant les cases 5 d vides du Xénon.
Exercice 3 :
Soit la molécule de formule brute CH2O2 :
On peut envisager (entre autres) les enchaînements d’atomes suivants pour cette molécule
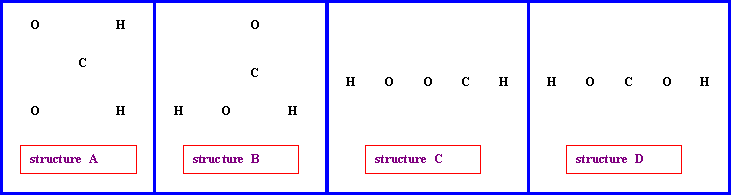
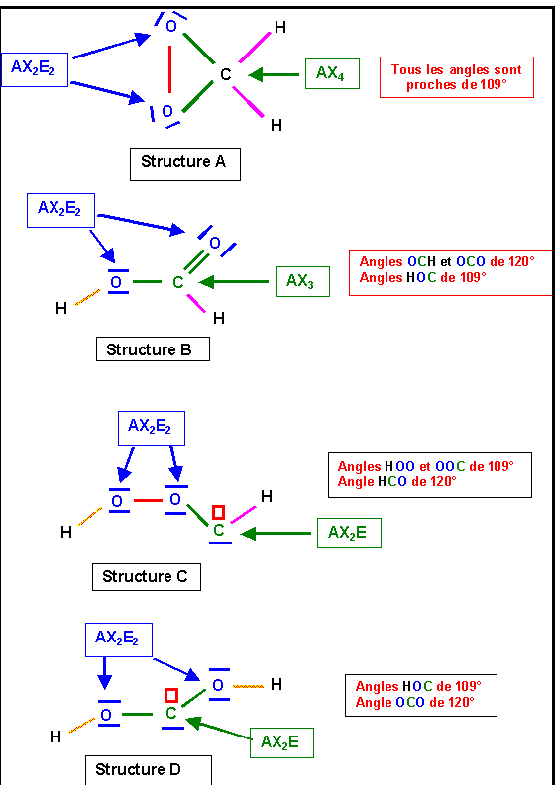
1) Proposer pour chacun de ces enchaînements une structure de Lewis moléculaire.
On fera apparaître les divers types de liaisons (simples, doubles ou triples) ainsi que les éventuels doublets libres et/ou cases quantiques vides.
2) Donner dans chaque cas la géométrie prévue par la méthode V.S.E.P.R. On précisera la valeur prévue pour les divers angles de liaison.
3) A partir des valeurs des rayons de covalence des atomes C, H et O on estimera les diverses longueurs de liaisons dans chaque cas (formules données plus haut)
4) Cette molécule existe réellement, il s’agit de l’acide méthanoïque (ou formique) HCOOH (structure B) et on a pu déterminer expérimentalement les diverses longueurs de liaisons ainsi que les divers angles de liaisons. On a trouvé les résultats suivants :
Longueurs des liaisons ( A°) : 0,95 - 1,09 - 1,25 - 1,31
Angles de liaisons ( °) : 108 - 118 - 118 - 124
a) Attribuer les diverses longueurs de liaisons observées.
b) Pour une des liaisons l’accord entre valeur calculée et expérimentale est nettement moins bon que pour les autres. De quelle liaison s’agit-il ? Montrer qu’il est possible d’expliquer ce mauvais accord par l’existence d’une forme mésomère faisant intervenir un des doublet libres de l’atome d’oxygène.
Montrer d’autre part que l’intervention de cette forme mésomère permet d’expliquer l’acidité importante (pKa=3,7) de l’acide formique.
Montrer de même que l’anion formiate HCOO- dont on donnera la structure de Lewis est fortement stabilisé par effet mésomère.
- Attribuer les divers angles de liaison observés.
Corrigé
Calcul des longueurs de liaisons :
On utilise la formule empirique du cours :
Liaison simple : l = 1,11 S Rcov - 0,203
Liaison double : 86 % de la liaison simple
Liaison triple : 78 % de la simple
Rcov =
0,215 n*2/Z* + 0,148 n* + 0,225
Pour H on prend RH = 0,346 A°
Rayons de covalence des atomes :
Z*C = 3,25 et n*C = 2 è RC = 0,786 A°
Z*O = 4,55 et n*O = 2 è RO = 0,710 A°
RH = 0,346 A°
Soit pour les longueurs des liaisons :
C - O : 1,46 A°
C = O : 1,25 A°
C - H : 1,05 A°
O - H : 0,97 A°
O - O : 1,37 A°
Acide Formique HCOOH
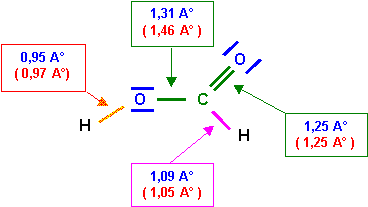
La simple liaison C - O est en réalité plus courte que la valeur approchée calculée grâce à la formule. L'accord est tout à fait satisfaisant pour les autres liaisons.
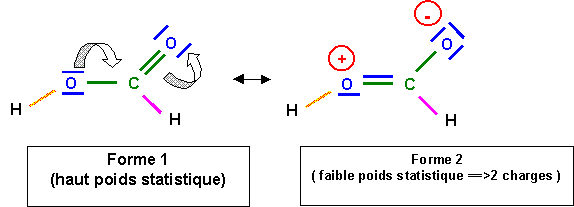
La liaison C - O à un faible caractère de double liaison à cause de la forme 2, cette liaison sera donc intermédiaire entre la simple et la double. Sa longueur de 1,31 A° est bien intermédiaire entre 1,25 et 1,46 A°. La longueur de la double liaison (qui devrait normalement légèrement augmenter) n'est en revanche pas sensiblement modifié, cela est général, les effets de raccourcissement sont toujours nettement plus sensibles que les effets d'allongement.
Dans la forme 2, l'atome d'oxygène lié a H porte une charge formelle positive, l'oxygène étant très électronégatif va chercher à se "débarrasser "de cette charge positive, pour cela il va "voler" les électrons de liaisons avec H. On obtient alors l'ion formiate HCOO- et H+ est libéré ce qui explique l'acidité importante de HCOOH.

Exercice 4 : L'Acide Nitrique HNO3
La figure suivante donne la géométrie de la molécule d'acide nitrique à l'état gazeux.
La molécule est plane dans ces conditions.
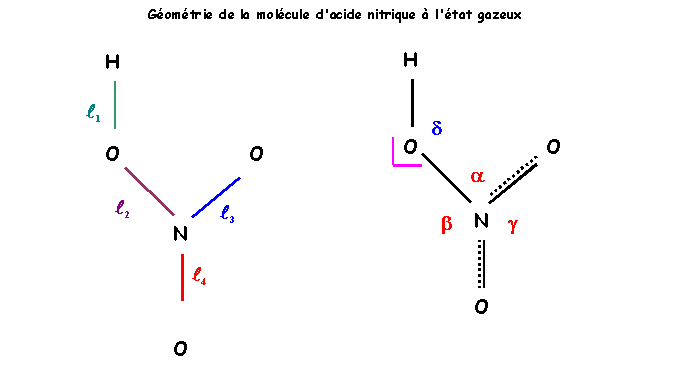
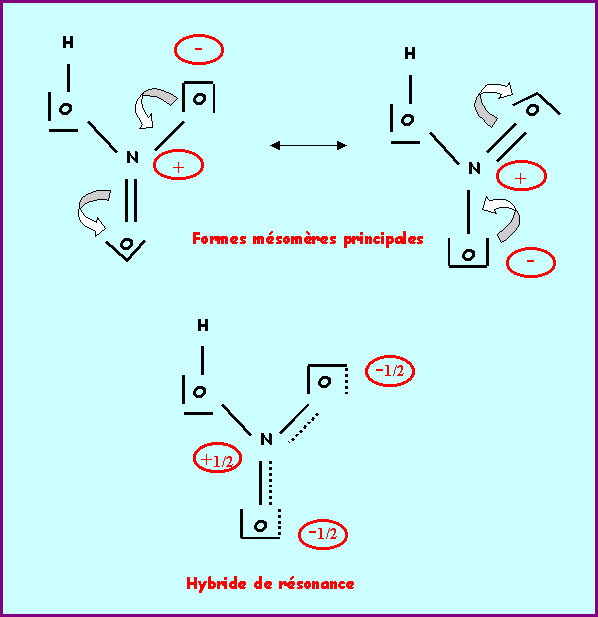
1) Donner le schéma de Lewis de cette molécule.
2 ) Montrer que plusieurs formes mésomères sont possibles et schématiser le passage d'une forme à l'autre.
La détermination expérimentale des longueurs de liaisons a donné les résultats suivants en phase gazeuse :
Longueurs des liaisons en A° : 0,96 - 1,21 - 1,21 - 1,41
- Complétez le tableau suivant :
|
Liaison |
l1 (OH) |
l2 (NO) |
l3 (NO) |
l4 (NO) |
|
Longueur
calculée (A°) |
0,97 A° |
1,41 A° |
1,21 A° |
1,21 A° |
|
Longueur expérimentale (A°) |
0,96 A° |
1,41 A° |
1,21 A° |
1,21 A° |
Calcul des longueurs de liaisons :
On utilise la formule empirique du cours :
Liaison simple : l = 1,11 S Rcov - 0,203
Liaison double : 86 % de la liaison simple
Liaison triple : 78 % de la simple
Rcov =
0,215 n*2/Z* + 0,148 n* + 0,225
Pour H on prend RH = 0,346 A°
Liaison OH :
O : 1s2
2s2 2p4
Z* = 8 -
( 5 * 0,35 ) - ( 2 * 0,85 ) = 4,55
RO
= 0,215 * 4 / 4,55 + 0,148 * 2 + 0,225 = 0,71 A°
Liaison simple OH : l = 1,11 * ( 0,71 + 0,346 ) - 0,203 = 0,97 A°
Liaison NO :
N : 1s2
2s2 2p3
Z* = 7 - ( 4 * 0,35 ) - ( 2* 0,85 ) = 3,9
RN = 0,215 * 4 / 3,9 + 0,148 * 2 + 0,225 = 0,74 A°
Liaison simple ON : l = 1,11 * ( 0,71 + 0,74 ) - 0,203 = 1,41 A°
Liaison double NO : 0,86 * 1,41 = 1,21 A°
Longueurs expérimentales des liaisons en A° : 0,96 - 1,21 - 1,21 - 1,41
L'attribution est aisée si on tient compte de la structure de l'hybride de résonance.
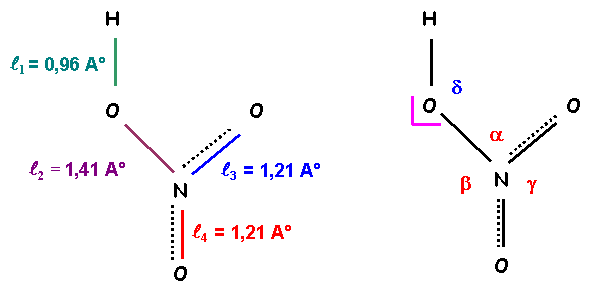
- Dans le modèle de Gillespie (V.S.E.P.R ou R.P.E.C.V) de quel type AXnEm est l'environnement de l'atome d'azote.
- AX3
- Quelles valeurs prévoit-on pour les angles ONO dans ce modèle ?
- a = 120 ° - b = 120 ° - g = 120 °
- Dans le modèle de Gillespie (V.S.E.P.R ou R.P.E.C.V) de quel type AXnEm est l'environnement de l'atome d'oxygène lié à l'atome d'hydrogène.AX2E2
- Quelle valeur prévoit-on pour l'angle NOH dans ce modèle ?
d = 109,5 °
La détermination expérimentale des angles de liaisons a donné les résultats suivants en phase gazeuse :
- Angles entres liaisons : 102° - 114° - 116° - 130°
8) Quel est l'angle qui vaut 102° ? Comparer avec sa valeur prévue par la méthode R.P.E.C.V. Justifier l'écart éventuel.
d = 102°
La présence des deux doublets libres sur l'atome d'oxygène provoque une fermeture de l'angle NOH, en effet, les répulsions doublet libre / doublet libre sont plus importantes que les répulsions doublet de liaison / doublet de liaison.
9) Les trois angles ONO ne sont pas identiques, l'un est nettement supérieur aux deux autres.
a) Quel est l'angle qui vaut 130° ?
b) Pourquoi cet angle est-il plus grand que les deux autres ?
g = 130°
Cet angle implique deux liaisons "doubles" (en fait intermédiaires entre simples et doubles) à cause des fortes répulsions double laison / double liaison cet angle s'ouvre et sa valeur est plus importante que la valeur prévue par la méthode R.P.E.C.V
c) Les deux autres angles sont très proches l'un de l'autre avec une différence de 2° seulement. Essayer de justifier cette petite différence.
La dissymétrie introduite par la présence de l'atome d'hydrogène fait que les deux angles sont très légèrement différents.
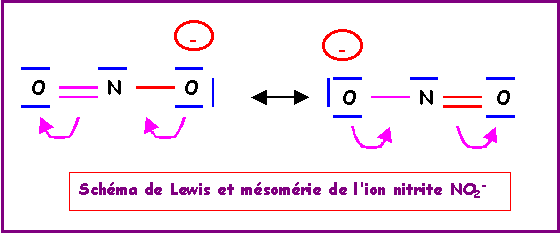
Exercice 5 : L'ion Azoture N3-
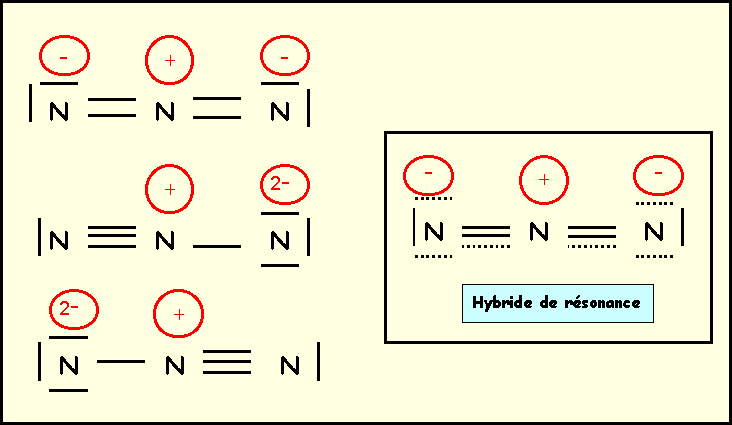
L’ion azoture N3- , bien que très instable, existe. Il est utilisé dans les airbags, sous le choc N3- se décompose en N2 qui gonfle l'airbag. Cet ion possède une géométrie linéaire, les deux liaisons NN sont identiques et de longueur 1,15 A°. Les trois atomes d'azote obéissent de plus à la règle de l'octet. Montrer que ces faits expérimentaux s'expliquent par l'interventions de plusieurs formes mésomères que l'on précisera. On donnera une représentation symbolique de l'hybride de résonance et on justifiera la géométrie linéaire et la longueur de liaison expérimentale.
Calcul des longueurs des liaisons NN :
N : 1s2
2s2 2p3
Z* = 7 - ( 4 * 0,35 ) - ( 2* 0,85 ) = 3,9
RN = 0,215 * 4 / 3,9 + 0,148 * 2 + 0,225 = 0,74 A°
Liaison simple NN : l = 1,11 * ( 0,74 + 0,74 ) - 0,203 = 1,44 A°
Liaison double NN : 0,86 * 1,44 = 1,24 A°
Liaison triple NN : 0,78 * 1,44 = 1,12 A°
Bien que de poids statistiques plus faibles les deux formes à triple liaison entraîne une diminution de la longueur de liaison qui est intermédiaire entre la double et la triple.
1,12 (triple) < 1,15 < 1,24 (double).
La géométrie
est bien de type AX2 linéaire pour les trois formes et les trois
atomes d'azote sont bien entourés chacun de 4 doublets.
Explications
supplémentaires :

Méthode
rapide :
1 N central = 5 électrons + 1 charge négative = 6 électrons
N latéral : Triple
liaison + 1 doublet
N central fait donc 6 liaisons,
il utilise ses six électrons et ne possède donc pas de doublet libre.
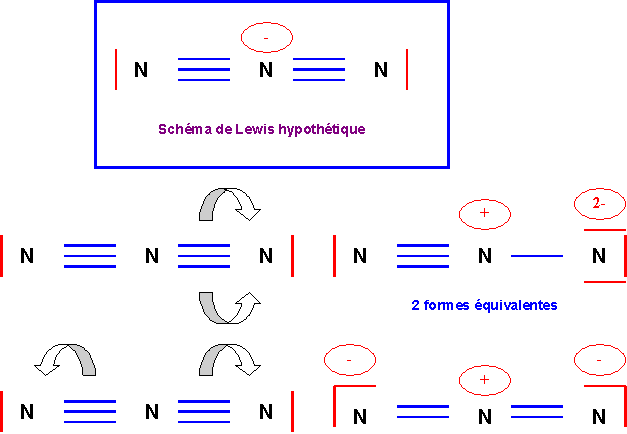
On obtient le schéma de
Lewis hypothétique qu’il convient de corriger. N ne pouvant faire que 4
liaisons au maximum on ramène des doublets vers les atomes latéraux.
Il y a deux façons de
procéder :
-
deux doublets transféré sur un
seul azote latéral
-
1 doublet transféré sur chacun
des azotes latéraux
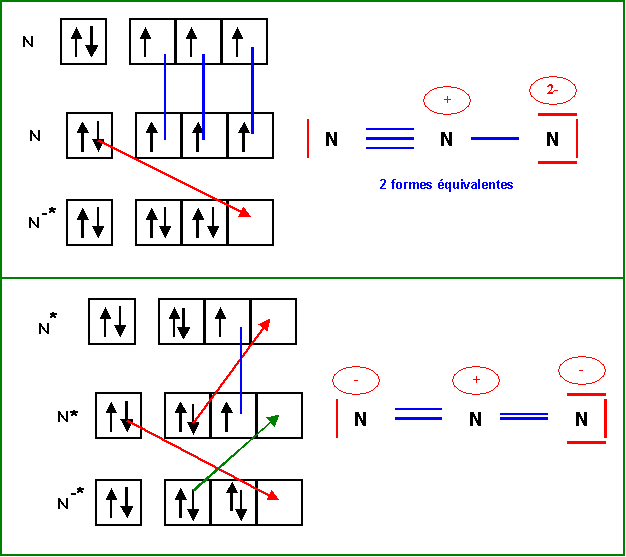
Méthode des
cases quantiques :
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com