Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com
SERIE 7 :
Quelques notions quantiques - Ondes de de Broglie - Principe d’Heisenberg - Equation de Schröeninger -
Exercice 1 :
1) Retrouver la forme de l'équation de Schröeninger :
F" + ( 8 P2 m / h2) ( E - V ) F = 0
En partant de l'équation d'une onde stationnaire dans un espace à une dimension de la forme :
f = A Sin (2 p x / l ) Cos ( 2 p n t)
Cette équation est obtenue en mécanique classique pour la vibration d'une corde entre deux bornes. En mécanique quantique elle correspond au cas simple d'un électron " dans une boite à une dimension " c'est à dire se déplaçant en ligne droite entre deux points. On dérivera deux fois la fonction d'onde par rapport à x puis on introduira la formule de De Broglie dans le cas de l'électron. On exprimera l en fonction de l'énergie cinétique de l'électron. On exprimera ensuite EC en fonction de ET et EP.
2) Chercher à partir de l'expression de la fonction d'onde les valeurs propres de l'énergie pour un électron se déplaçant en ligne droite entre deux points. Pour cela on introduira la condition de quantification correspondant au fait que la fonction d'onde s'annule pour les deux bornes. On exprimera cette condition par analogie avec une corde vibrante. On supposera pour simplifier le problème que l'électron est dans un puis de potentiel, c'est à dire que le potentiel est nul à l'intérieur de la "boite à une dimension" et infini à l'extérieur.
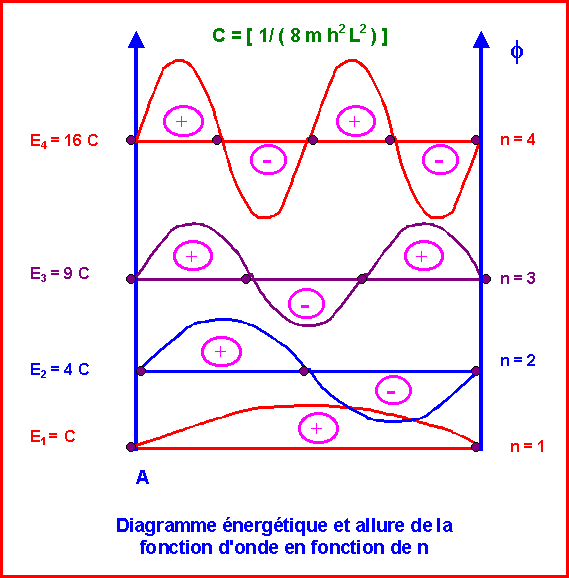
3) Sur un schéma on représentera les valeurs propres de l'énergie en fonction du nombre quantique principal ainsi que l'allure de variation de la fonction d'onde correspondante pour les trois premières valeurs de n. Enfin on représentera la variation du carré de la fonction d'onde. A quoi correspond cette dernière ?
On précisera le signe de la fonction d'onde, le nombre de lobes et le nombre de noeuds.
Corrigé :
Equation de Schrödinger
f = A sin ( 2 p x / l) cos ( 2 p n t )
Le terme A cos ( 2 p n t ) ne dépend pas de x et peut donc être considéré comme constant, posons :
A cos ( 2 p n t ) = B
f = B sin ( 2 p x / l)
f' = [ 2 p B / l ] cos ( 2 p x / l)
f'' = [ - 4 p2 B / l2 ] sin ( 2 p x / l)
f'' = [ - 4 p2 / l2 ] B sin ( 2 p x / l)
f'' = [ - 4 p2 / l2 ] f
Formule de de Broglie
l = h / p
l2 = h2 / p2
p = m v
p2 = m2 v2
EC = 1/2 m v2
m EC = 1/2 m2 v2
2 m EC = m2 v2 = p2
1/ l2 = p2 / h2 = 2 m EC / h2
f'' = - 4 p2 / l2 f = [ - 8 p2 m EC / h2] f = [ - 8 p2 m / h2] EC f
ET = EC + EP
EC = ET - EP = E - V
f'' = [ - 8 p2 m / h2] (E - V) f
f'' + [ 8 p2 m / h2] (E - V) f = 0
Dans ce problème "a une seule dimension", on retrouve bien l'équation de Schrödinger, en mécanique quantique, sa généralisation à trois dimensions est postulée.
Valeurs propres de l'énergie :
Corde vibrante
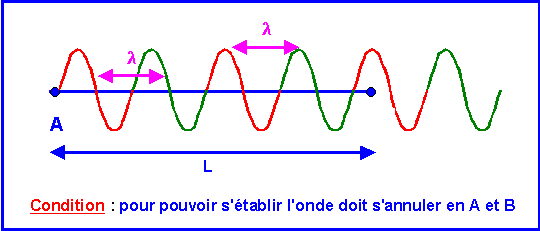
Supposons une corde vibrante tendue entre deux points A et B distant d'une longueur L.
Pour qu'une onde stable stationnaire puisse s'établir, il faut que celle-ci puisse faire des aller-retour entre les deux points sans interférer avec elle-même. Cela introduit une contrainte, la longueur d'onde ne peut pas être quelconques mais ne peut prendre que certaines valeurs bien précise, il y donc une quantification de la fonction d'onde.
La condition est que l'onde s'annule aux deux extrémités A et B.

Pour cela il faut que la longueur entre A et B contienne un nombre entier de fois la demi-longueur d'onde
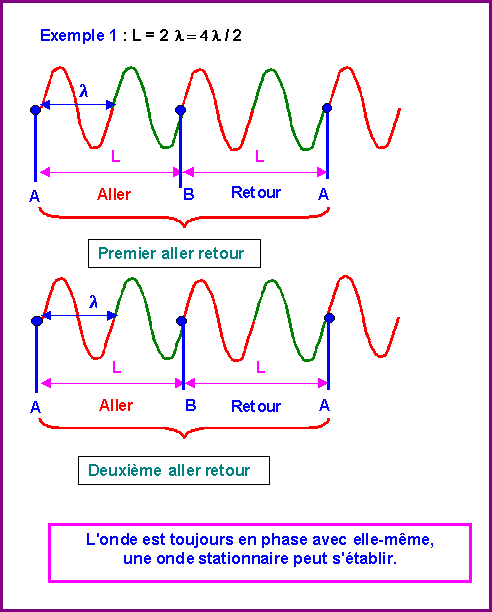
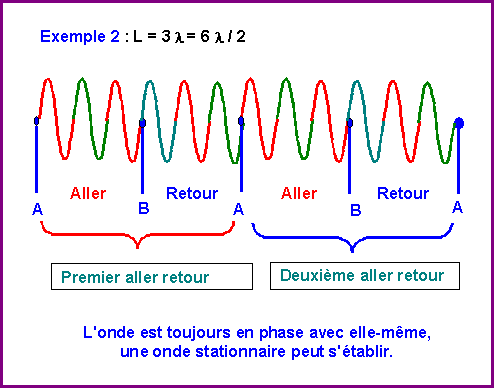
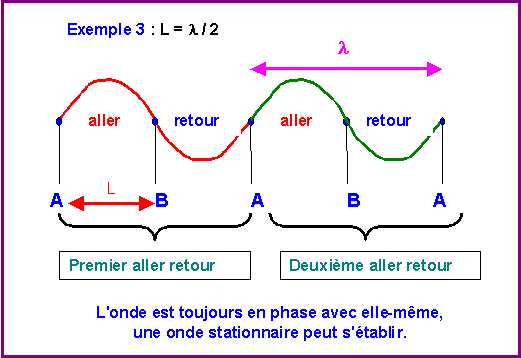
L = k l / 2 avec k entier
Prenons des exemples :
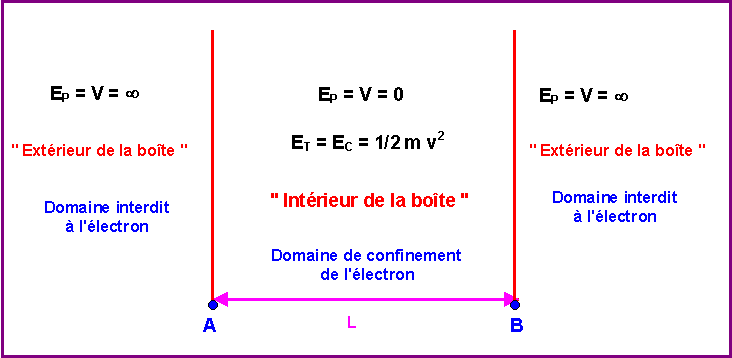
Par analogie, pour un électron dans une "boite à une dimension" :
A l'intérieur de la boîte l'énergie potentielle est nulle et l'électron possède une énergie purement cinétique.
A l'extérieur de la boîte l'énergie potentielle est infinie et l'électron ne peut donc sortir de la boîte à l'intérieur de laquelle il est confiné.
Calcul de l'énergie :
EC = 1/2 m v2
m EC = 1/2 m2 v2
2 m EC = m2 v2 = p2
1 / l2 = p2 / h2 = 2 m EC / h2
L = k l / 2 (avec k entier)
1 / l = k / 2 L
1 / l2 = k 2 / 4 L2
1 / l2 = 2 m EC / h2 = k 2 / 4 L2
2 m EC / h2 = k 2 / 4 L2
EC = ET = [1/ 8 m h2 ] { k2 / L2 }
L'énergie de l'électron à l'intérieur de la boîte est quantifiée et ne peut donc prendre que certaines valeurs bien précises fonction d'un nombre entier k appelé nombre quantique principal. Elle dépend également de la longueur L de la boîte, et est inversement proportionnelle au carré de celle-ci..
3) Représentations graphiques
EC = ET = [ 1/ ( 8 m h2 ) ] { k2 / L2 } = [ 1/ ( 8 m h2 L2 ) ] k2
On pose pour alléger l'écriture
Soit : E = C k2
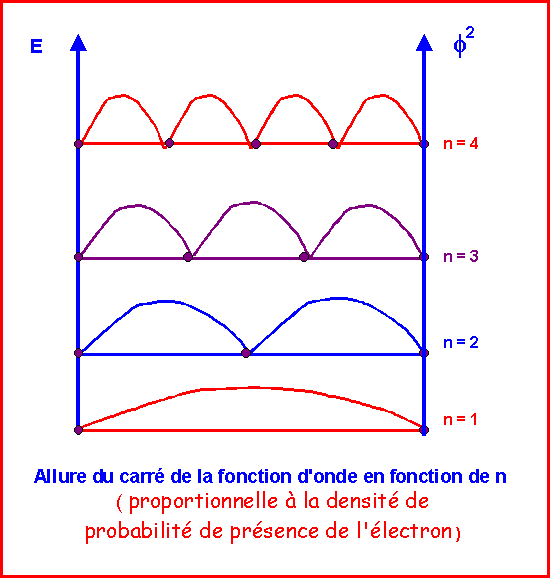
Un nœud est un point pour lequel la fonction d'onde s'annule.
Le carré de la fonction d'onde est proportionnel à la densité de probabilité de présence de l'électron en un point.
La probabilité de présence est nulle aux nœuds et maximale entre les nœuds.
k |
Nombre de noeuds |
Nombre de lobes |
1 |
2 |
1 |
2 |
3 |
2 |
3 |
4 |
3 |
4 |
5 |
4 |
Exercice 2 :
Calculer les longueurs d'onde associées aux systèmes matériels suivants :
a) balle de revolver de 2 g lancée à 300 m/s
b) voiture de 2 t à 100 km/h
c) électron se déplaçant à 3 104 m/s
Formule de De Broglie :
l = h / p = h / m v
Constante de Planck : h = 6,63 10-34 J.s
l = h / p = 6,62 10-34 / 0,6 = 1,1 10-33 m
Cette onde est totalement indécelable car sa longueur d'onde est beaucoup trop courte pour pouvoir être détectée expérimentalement.
A l'échelle macroscopique les ondes de De Broglie sont totalement négligeables.
m = 2 103 Kg
v = 100 103 / 3600 = 27,8 m s-1
p = 2 103 * 27,8 = 55,6 Kg.m.s-1
l = h / p = 6,62 10-34 / 55,6 = 1,2 10-35 m
Cette onde est totalement indécelable car sa longueur d'onde est beaucoup trop courte pour pouvoir être détectée expérimentalement.
A l'échelle macroscopique les ondes de De Broglie sont totalement négligeables.
m = 9,1 10-31 Kg
p = 9,1 10-31 * 3 104 = 2,73 10-26 Kg.m.s-1
l = h / p = 6,62 10-34 / 2,73 10-26 = 2,4 10-8 m
Cette onde est tout à fait décelable expérimentalement.
A l'échelle des objets quantiques les ondes de De Broglie se manifestent expérimentalement (diffraction des électrons par les cristaux par exemple), on ne peut donc les ignorer et on doit absolument en tenir compte, c'est le but de la mécanique ondulatoire quantique.
Exercice 3 :
Exprimer le caractère ondulatoire d'un électron sur une orbite de Bohr et retrouver la condition de quantification du moment cinétique.
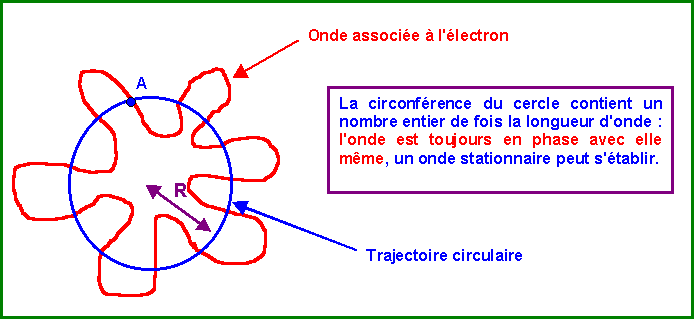
L'électron en tournant sur son orbite circulaire est "accompagné" de son onde de De Broglie qui tourne avec lui. Pour que l'onde puisse être stationnaire il faut qu'elle n'interfère pas avec elle-même (soit en phase avec elle-même).
Cette condition n'est remplie que si la longueur de la trajectoire contient exactement un nombre entier de fois la longueur d'onde.
Soit 2 p R = n l = n (h / p) = n (h / m v )
soit finalement : m v R = n ( h / 2 p)
On retrouve la condition de quantification du moment cinétique postulée par Bohr, mais elle trouve ici une explication rationnelle.
Exercice 4 :
a) Si l'on suppose que le rayon de l'orbite de Bohr a0 = 0,529 A° est connu à 1% près, calculer DV incertitude sur la vitesse de l'électron de masse 9,1 10-31Kg. Conclusion ?
b) Si l'on suppose que la position d'une bille de masse 1 g est connue au mm près, quelle est l'incertitude sur sa vitesse ? Conclusion ?
Inégalité d'Heisenberg :
Dp Dx > h / (2 p )
p = m v
Dp = m Dv
Dx Dv > h / ( 2 p m )
Dv > h / ( 2 p m Dx)
a) m = 9,1 10-31 Kg - x = 0,529 A° - Dx / x = 0,01
Dx = 0,01 x = 0,00529 10-10 m
Dv > h / ( 2 p m Dx)
Dv > 6,62 10-34 / ( 2 p * 9,1 10-31 * 0,00529 10-10)
Dv > 2,2 108 m s-1
L'incertitude sur la vitesse est énorme puisqu'elle est d'environ 10% de la vitesse de la lumière qui est la vitesse la plus grande qui puisse exister d'après la théorie de la relativité d'Einstein.
b) m = 10-3 Kg - Dx = 10-6 m
Dv > h / ( 2 p m Dx)
Dv > 6,62 10-34 / ( 2 p * 10-3 * 10-6)
DV > 10-25 m s-1
Cette incertitude est extrêmement faible et correspond en fait à une précision extraordinaire.
c) m = 1500 Kg - v = 120 Km h-1 = 33,3 m.s-1
Supposons pour fixer les idées, que l'instant du contrôle soit connu à la seconde prés, cela équivaut a une incertitude de Dx = 33,3 m sur la position du véhicule.
Dv > h / ( 2 p m Dx)
Dv > 6,62 10-34 / ( 2 p * 1500 * 33,3) = 2,1 10-39 m.s-1
La vitesse du véhicule est parfaitement déterminée et les protestations sont donc inutiles.
Comme les ondes de De Broglie, le principe d'Heisenberg ne se manifeste pas à notre échelle macroscopique. Inutile de l'invoquer en cas de contrôle de vitesse, les forces de l'ordre connaissent avec précision et votre vitesse et votre position. En revanche ce principe d'incertitude est incontournable à l'échelle des atomes ou des molécules.
Thierry Briere - T.D Initiation à la chimie théorique - http://www.chimie-briere.com