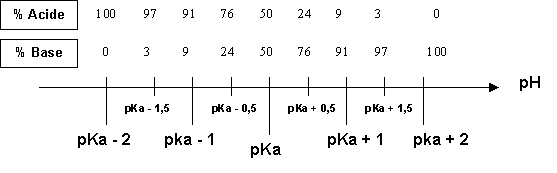
Thierry Briere : www.chimie-briere.com
P.C.E.M : Résumé de cours
FORMULAIRE ACIDES ET BASES

ACIDES
pC < 6 : pH = pC
pC > 7 : pH = 7
6 < pC < 7 : h = ( C0 + Ö [C02 + 4 Ke] ) / 2 - pH = - log h
pC < pKa - 1 : pH = 1/2 (pKa + pC)
pC > pKa + 1 : pH = pC
pC > 7 : pH = 7
pKa - 1 < pC < pKa + 1 : h = { -Ka + Ö [ Ka2 + 4 Ka C0 ] } / 2 - pH = - log h
BASES : Même formules que les acides en remplaçant H par OH et Ka par Kb
w = [OH-]
pC < 6 : pOH = pC è pH = 14 - pC
pC > 7 : pOH = pH = 7
6 < pC < 7 : w = ( C0 + Ö [C02 + 4 Ke] ) / 2 - pOH = - log w è pH = 14 + log w
pC < pKb - 1 : pOH = 1/2 (pKb + pC)
pC > pKb + 1 : pOH = pC
pC > 7 : pH = 7
pKb - 1 < pC < pKb + 1 : w = { -Kb + Ö [ Kb2 + 4 Kb C0 ] } / 2 - pH = 14 + log w
Mélange acide + base conjuguée = Solution tampon
pH = pKa + log { [Base] / [Acide] }
Propriétés des solutions tampon :
Mélange d'un acide faible et de sa base conjuguée. Fixent le pH du milieu. Le pH varie très peu par ajout de petites quantités d'acide fort ou de base forte et varie très peu par dilution.
Diagramme de prédominance
Calculs des pourcentages de chaque espèce :
R = [Base] / [Acide]
pH = pKa + log [Base] / [Acide] = pKa + log R
log R = pH - pKa
R = 10(pH-pKa)
[Base] = R [Acide]
[Base] + [Acide] = C
R [Acide] + [Acide] = C
[Acide] = C / ( 1+ R ) - %Acide = 100 / (1 + R )
[Base] = R C / ( 1+ R ) - %Base = 100 R / (1 + R )
Mélanges d'acides - Polyacides - Mélanges de bases - Polybases
Il suffit dans la très grande majorité des cas de considérer que c'est l'espèce la plus forte qui fixe le pH et calculer celui-ci en considérant que l'espèce la plus forte est seule en solution.
Ampholythe : pH = 1/2 ( pK1 + pK2 )
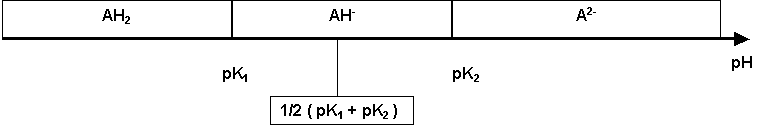
Calcul des concentrations de chaque espèces :
R1 = [AH-] / [AH2]
pH = pKa1 + log [AH-] / [AH2] = pK1 + log R1
log R1 = pH - pK1
R1 = 10(pH-pK1)
[AH-] = R1 [AH2]
R2 = [A2-] / [AH-]
pH = pK2 + log [A2-] / [AH-] = pK2 + log R2
log R2 = pH - pK2
R2 = 10(pH-pK2)
[A2-] = R2 [AH-]
[A2-] = R1 R2 [AH2]
[A2-] + [AH-] + [AH2] = C
R1 R2 [AH2] + R1 [AH2] + [AH2] = C
[AH2] = C / { 1 + R1 + R1R2 } %AH2 = 100 / { 1 + R1 + R1R2 }
[AH-] = C R1 / { 1 + R1 + R1R2 } %AH- = 100 R1 / { 1 + R1 + R1R2 }
[A2-] = C R1 R2 / { 1 + R1 + R1R2 } %A2- = 100 R1 R2 / { 1 + R1 + R1R2 }
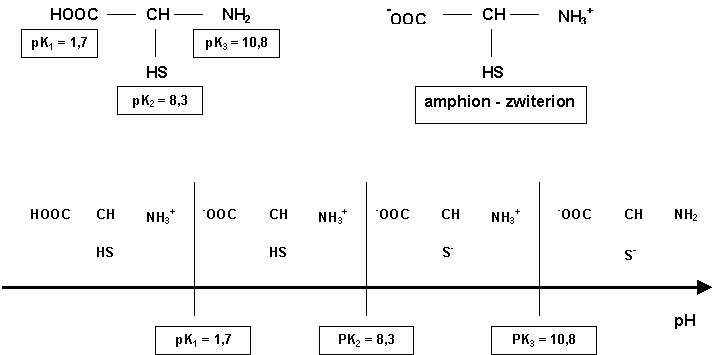
Acide aminé simple : HOOC - RCH - NH2
Possède à la fois une fonction acide COOH ( 2 < pKa < 6 )et une fonction basique NH2 ( 8 < pKa < 12 ). En solution la réaction acide base intramoléculaire est pratiquement totale, on obtient un Amphion ou Zwiterion -OOC - RCH - NH3+ qui se comporte exactement comme un ampholythe.
pH = 1/2 (pK1 + pK2)
Ce pH est appellé pH isoélectrique, à ce pH la concentration du zwiterion est maximale.
Amélioration de l'approximation (à n'utiliser qu'en cas de valeurs extrèmes des pK ou des concentrations très faibles)
Si pK1 + pK2 > 14 : OH- non négligeable
pH = 1/2 { pK1 + pK2 - log ( 1 + Ke / K2C ) }
Si pK1 + pK2 < 14 : H3O+ non négligeable
pH = 1/2 { pK1 + pK2 - log ( C / ( K1 + C) ) }
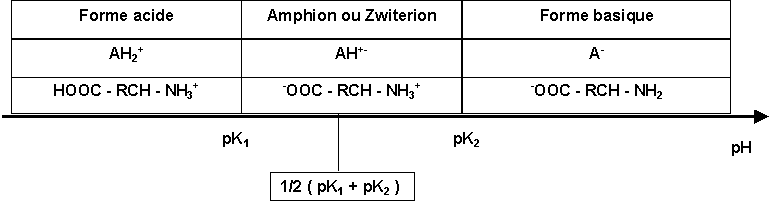
Exemple d'acide aminé à 3 fonctions acido-basiques :
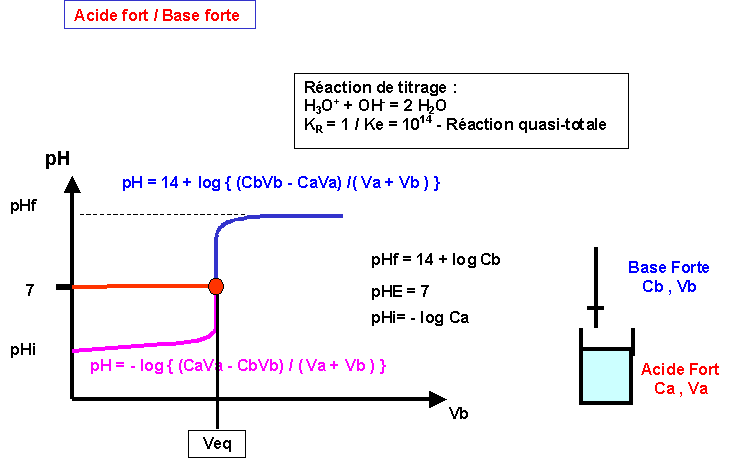
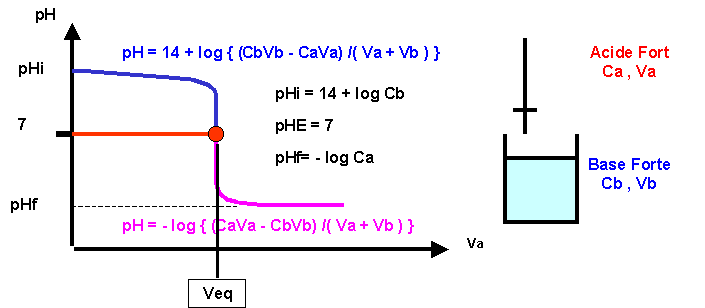
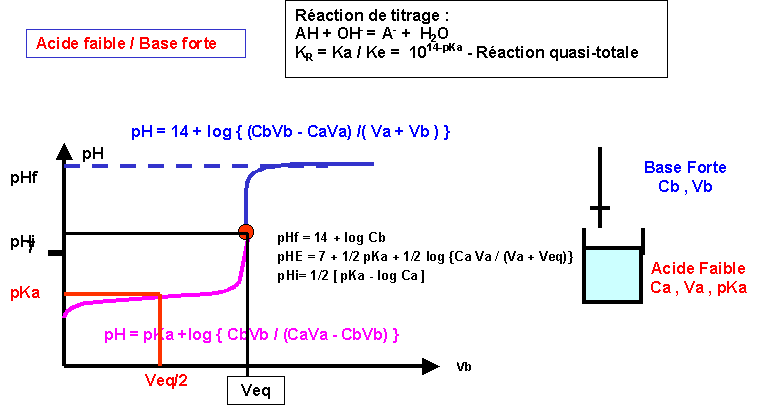
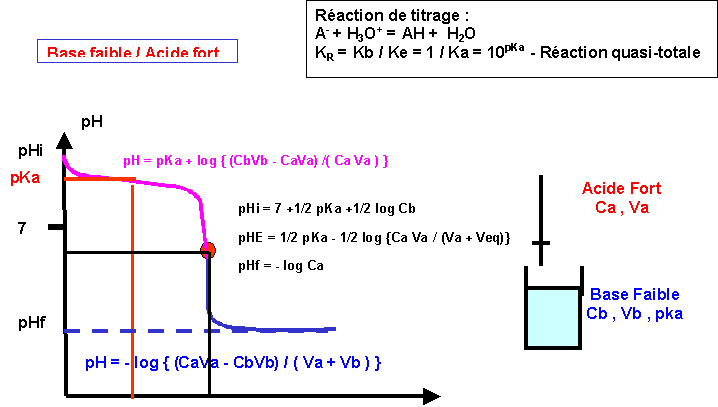
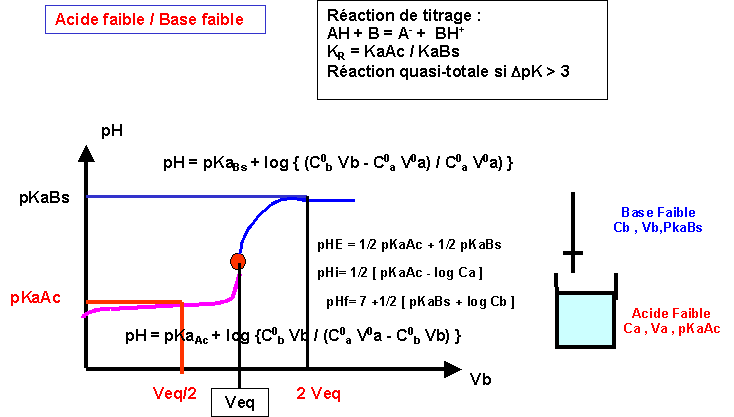
Titrages
Thierry Briere : www.chimie-briere.com