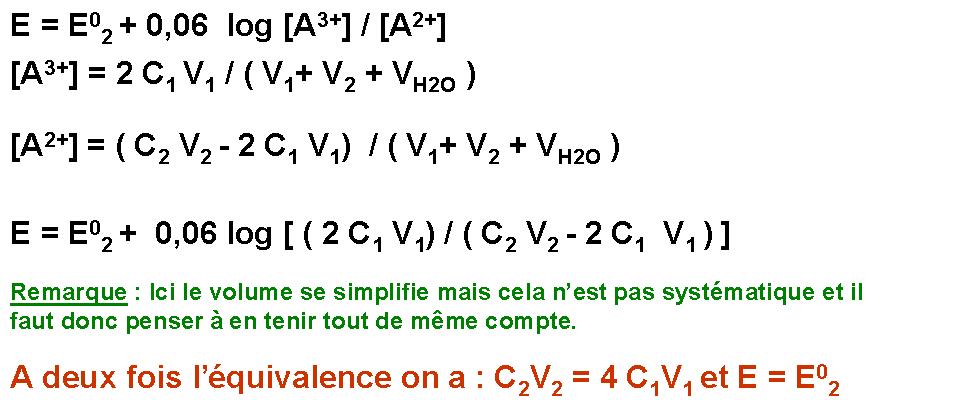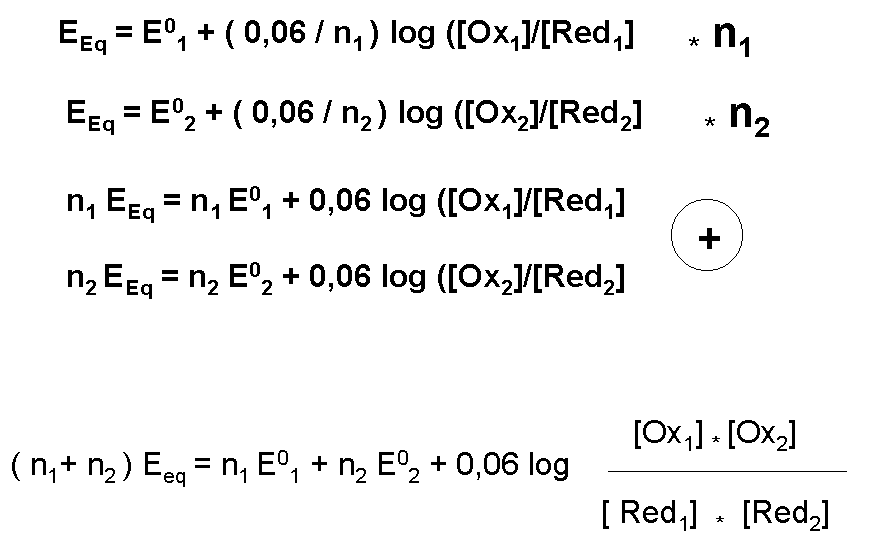
OXYDO-REDUCTION
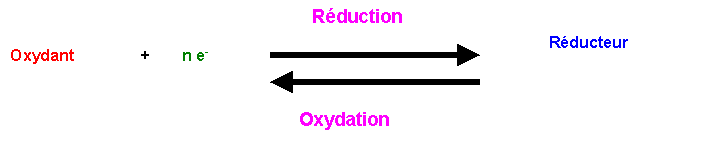
Couple oxydo-réducteur - 1/2 réaction d'oxydo-réduction

Les deux substances sont dites Espèces Conjuguées.
Le passage d’une forme à l’autre implique une variation du nombre d’électrons.
Ox est TOUJOURS du coté des électrons
Réaction d'oxydoréduction :
L'oxydant d'un couple réagit avec le réducteur d'un autre couple. Des électrons sont échangés d'une espèce à l'autre. Les électrons sont simplement transférrés, il n'y a jamais ni création ni destruction d'électrons.
1/2 réaction 1 : n2 { Ox1 + n1 e- = Red1 }
1/2 réaction 2 : n1 { Red2 = Ox2 + n2 e- }
Réaction globale : n2 Ox1 + n1 Red2 = n1 Red2 + n2 Ox1
Equilibrage des 1/2 réactions :
Milieu acide
1) Atomes "ordinaires" (sauf O et H)
2) O en ajoutant H2O
3) H en ajoutant H+
4) Charges en ajoutant e-
95% des cas H+ du coté de Ox et H2O du coté de Red:
Ox + p H+ + n e- = Red + q H2O
Milieu basique :
Ox + p H+ + n e- = Red + q H2O
Ox + p H+ + p OH- + n e- = Red + q H2O + pOH-
Ox + p H2O + n e- = Red + q H2O + pOH-
Ox + n e- = Red + ( q - p ) H2O + q OH- (Si p < q )
Potentiel de référence d'un couple : E0
"Analogue" au pKa des couples acide/base
(avec oxydant = base et réducteur = acide)
Grandeur caractéristique du couple exprimée en Volts V.
Plus le E0 est élevé et plus l'oxydant du couple est fort.
Plus le E0 est faible et plus le réducteur du couple est fort.
Plus le E0 est faible et plus l'oxydant du couple est faible
Plus le E0 est élevé et plus le réducteur du couple est faible.
Par convention E0 H+/H2 = 0,000 V (Couple de référence)
Loi de Nernst - Potentiel de Nernst :
E = E0 + (RT/nF) ln Q
R = Cte des gaz parfaits : R = 8,31 J.mol-1
F = Le Faraday = charge d'une mole d'e- = Ne = 96500 C
T = température absolue en Kelvins K
Ln(x) = 2,3 log(x)
A 25 °C avec log décimal : E = E0 + 0,059 log Q
Q = Monôme des activité de la 1/2 réaction Ox + ne- = Red
Q =
P aivi : Expression identique à celle de K mais avec les activités INITIALES et non celles à l'état d'équilibre.Prévision de la réaction spontanée entre deux couples
La réaction spontanée se produisant dans les conditions standards entre deux couples d’oxydoréduction est celle qui se produit entre le meilleur oxydant (de E0 le plus élevé) et le meilleur réducteur (de E0 le plus faible).
Conditions standards : Toutes les concentrations sont obligatoirement égales à 1 mol.L-1. Pour les gaz Pi = 1 bar. La température peut être quelconque mais les tables donnent des valeurs a 25 °C (298 K).
Conditions standards biologiques:
Toutes les concentrations autres que celle de l'ion H3O+ (égale à 10-7 mol.L-1 soit pH = 7) sont obligatoirement égales à 1 mol.L-1. Pour les gaz Pi = 1 bar. La température peut être quelconque mais les tables donnent des valeurs a 25 °C (298 K). (Dans ces conditions on définit un E0 apparent E0'pH=7 ).
Dans les conditions non-standards il faut comparer le potentiel de Nernst E de chaque couple dans les condition données le couple de E le plus élevé sera le couple oxydant et celui de E le plus faible le couple réducteur.
En général peu d'influence mais méfiance !
"Règle" du
a (moyen mnémotechnique) 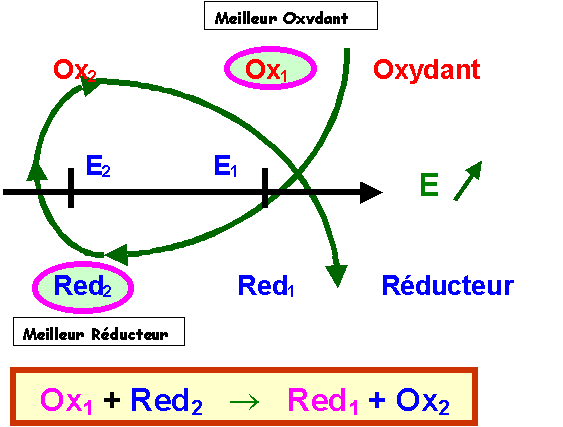
Réaction spontanée
: C'est la réaction thermodynamiquement favorisée et donc de K le plus élévé. "La réaction inverse se produit beaucoup moins mais existe tout de même".Calcul des constantes d'équilibre des réactions d'oxydoréduction :
n2 [ Ox1 + n1 e- = Red1 ] (Couple oxydant)
n1 [Red2 = Ox2 + n2 e- ] (Couple réducteur)
n2 Ox1 + n1 Red2 = n2 Red1 + n1 Ox2
K = [Red1]n2 [Ox2] n1 / [Ox1] n2 [Red2] n1
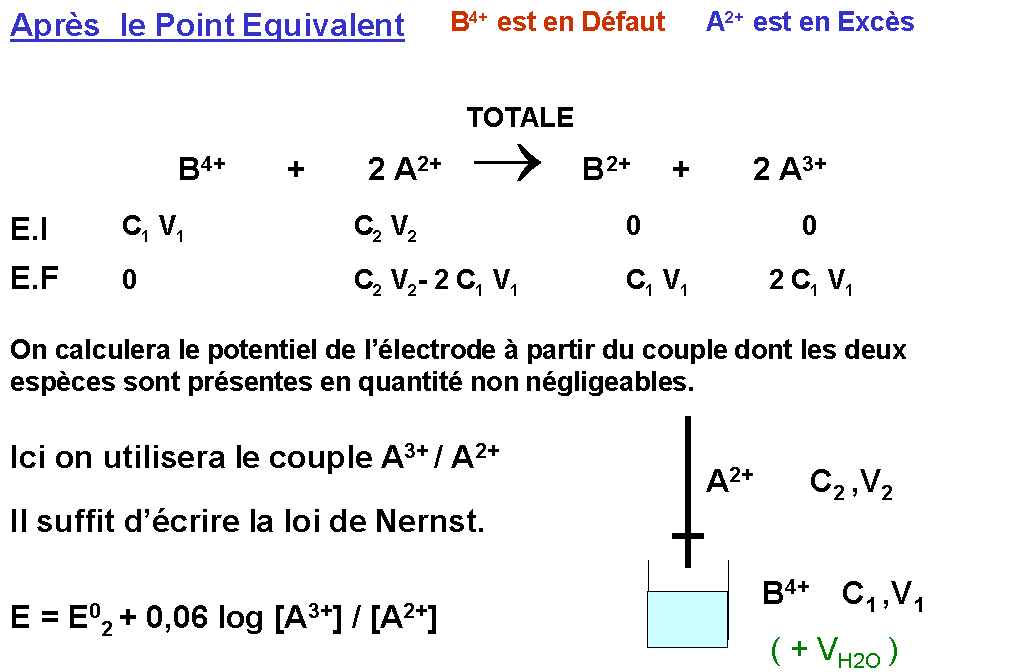
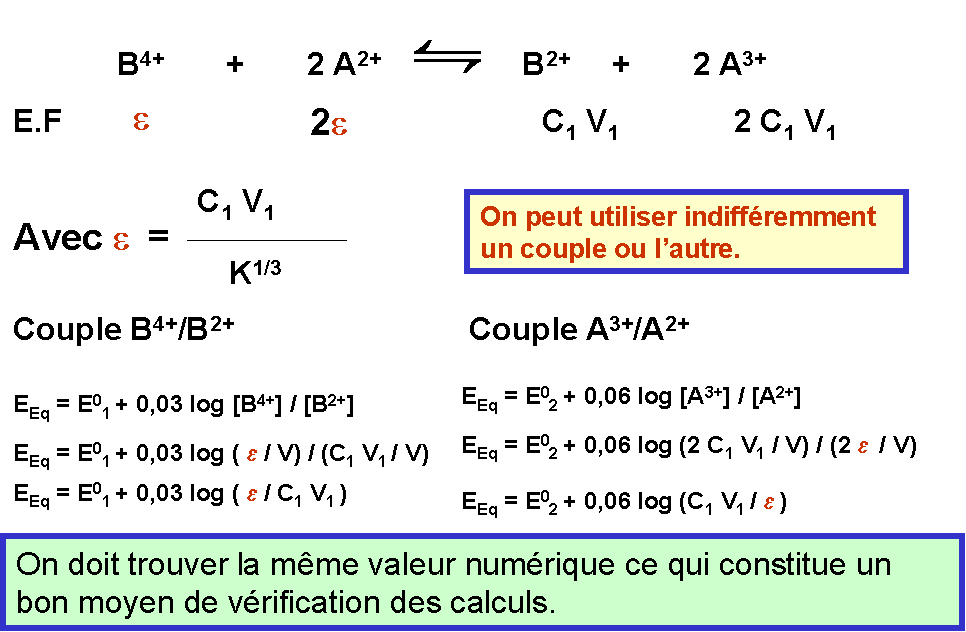
A l'équilibre les deux couples sont simultanément présents, le potentiel de Nernst de la solution est calculable indifféremment soit avec un couple soit avec l'autre.
E = E01 + (0,06 / n1) log { [Ox1] / [Red1] } = E02 + (0,06 / n2) log { [Ox2] / [Red2] }
E01 - E02 = (0,06 / n1n2) log { [Ox2]n1 / [Red2]n1 } - (0,06 / n1n2) log { [Ox1]n2 / [Red1]n2}
E01 - E02 = 0,06/n1n2 log { [Ox2] n1/ [Red2] n1 } + 0,06 log { [Red1] n2 / [Ox1] n2}
E01 - E02 = 0,06/n1n2 log { [Ox2] n1 [Red1] n2 / [Ox1] n2 [Red2] n1 }
n1 n2 (E01 - E02) / 0,06 = log K
log K = n1 n2
DE0 / 0,06avec
DE0 = E0 couple oxydant - E0 couple réducteurAttention : si n1 = n2 = n
è log K = n DE0 / 0,06Règle pratique : si K > 105
è Réaction totaleSi n1=n2=1 : log K = 5 =
DE0 / 0,06 è DE0 = 0,06 * 5 = 0,3 VSi
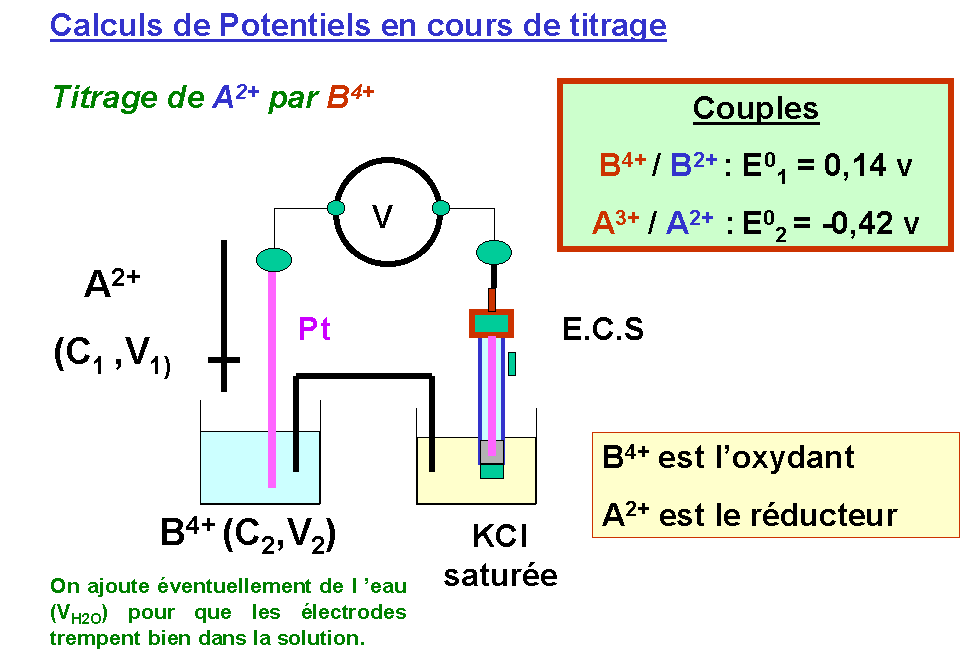
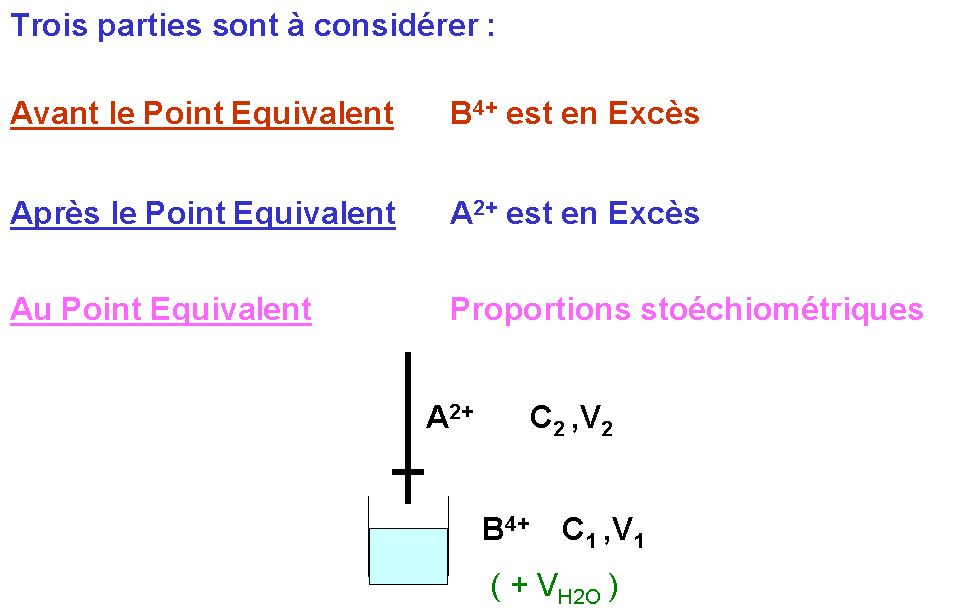
DE0 > 0,3 V la réaction peut être considérée comme totale.Titrage d'oxydoréduction :
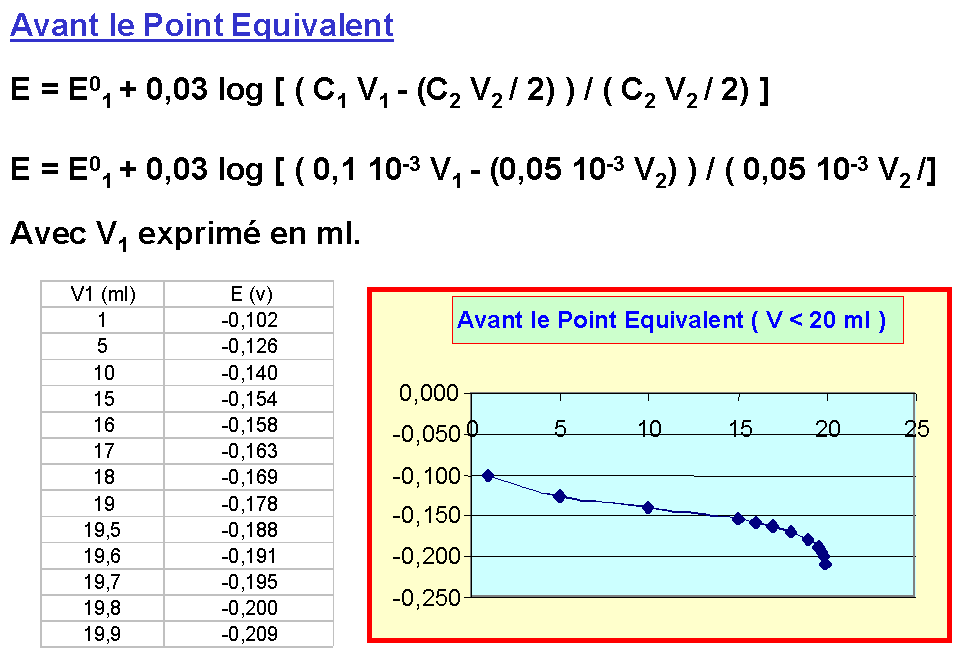
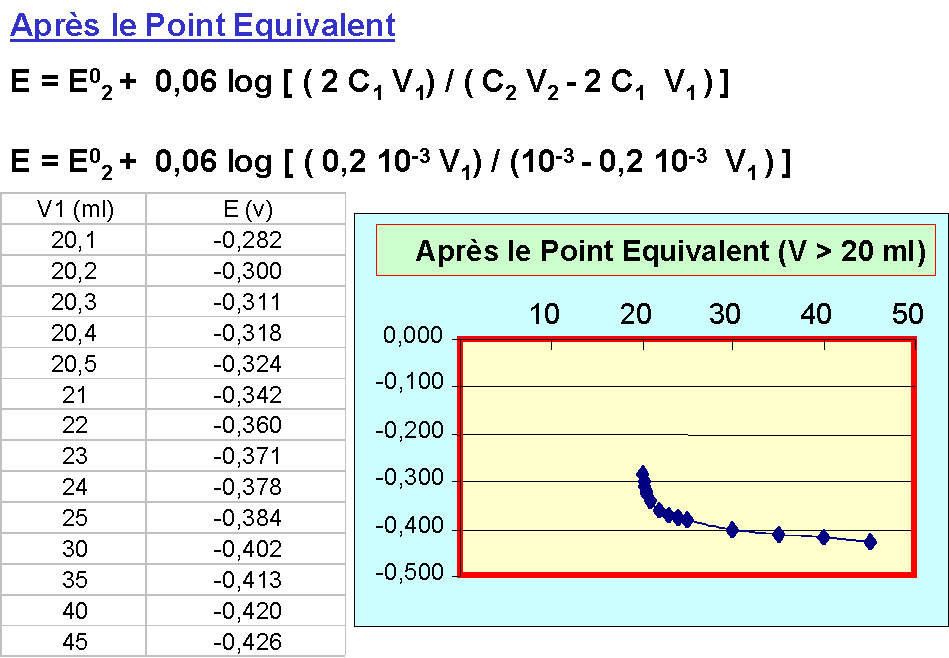
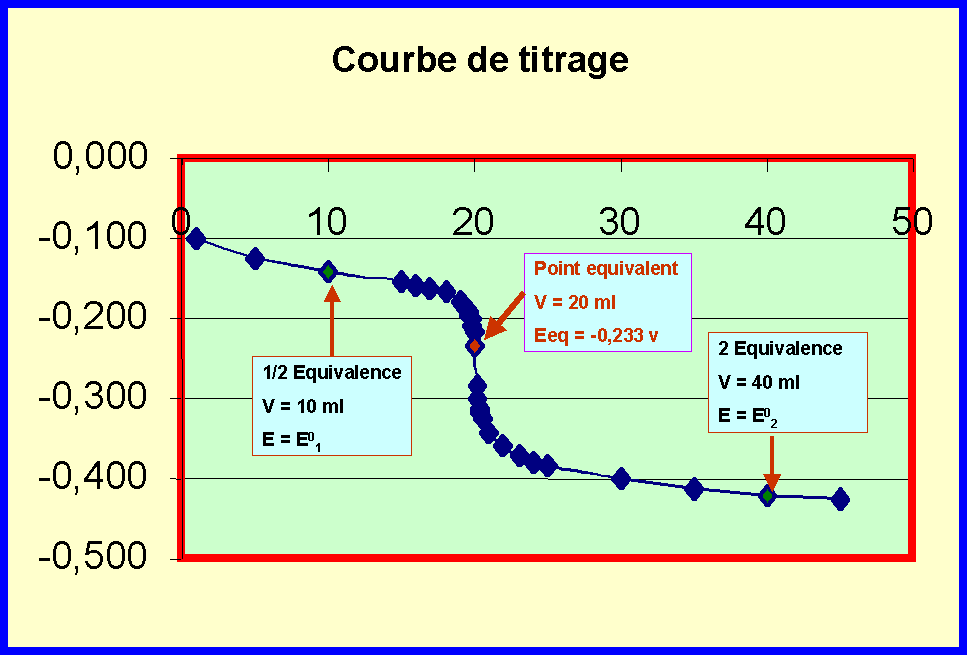
Relation fondamentale au point équivalent
n2 [ Ox1 + n1 e- = Red1 ] (Couple oxydant)
n1 [Red2 = Ox2 + n2 e- ] (Couple réducteur)
n2 Ox1 + n1 Red2 = n2 Red1 + n1 Ox2
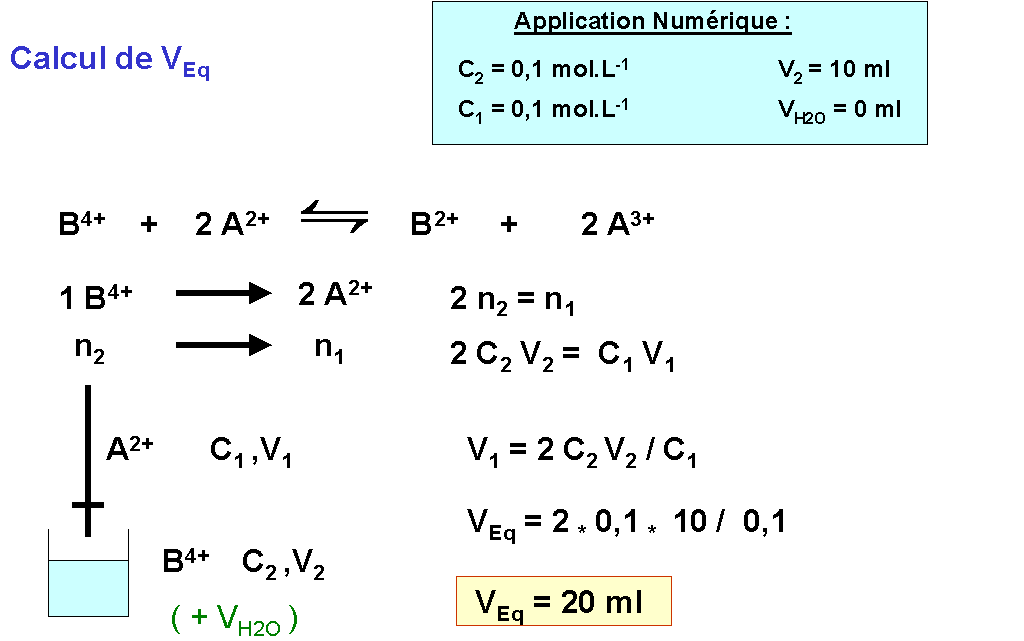
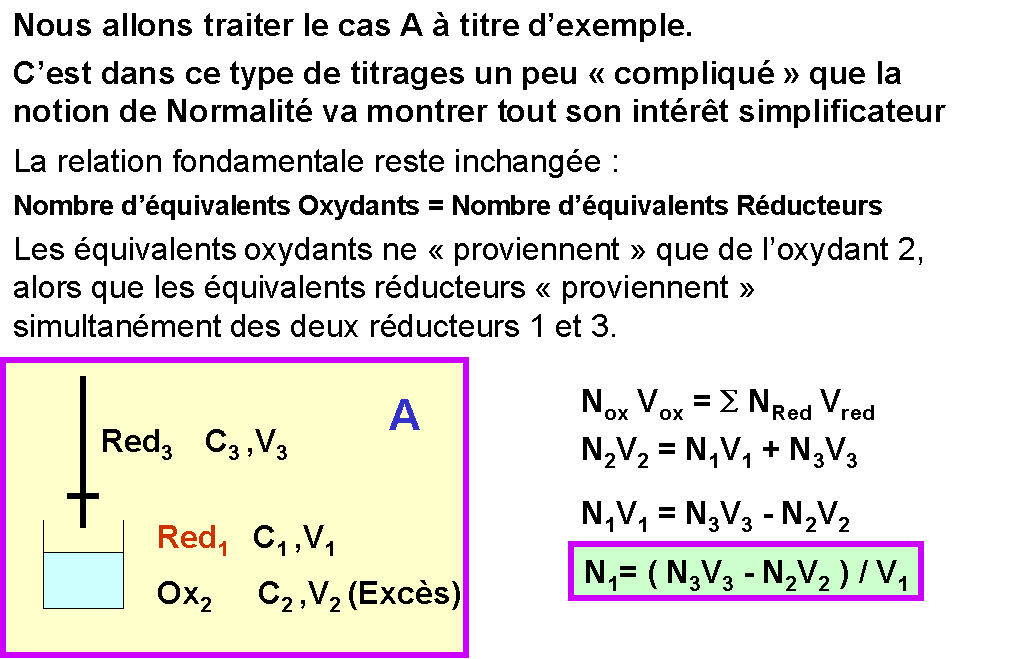
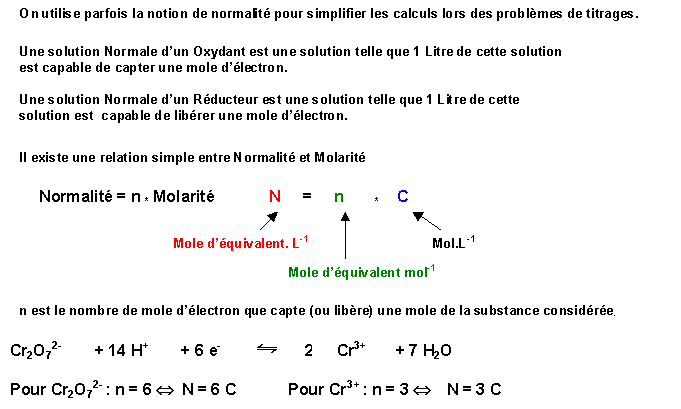
Avec les molarités : Avec les normalités :
n1 C1 V1 = n2 C2 V2 N1 V1 = N2 V2
Variation de E avec le pH
95 % des cas
Ox + p H+ + n e- = Red + q H2O
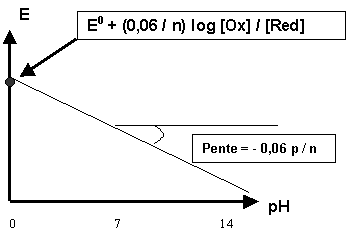
E = E0 + (0,06 / n) log [Ox] [H+]p / [Red]
E = E0 + (0,06 / n) log [Ox] / [Red] + (0,06 / n) log [H+]p
E = E0 + (0,06 / n) log [Ox] / [Red] + (0,06 p / n) log [H+]
E = E0 + (0,06 / n) log [Ox] / [Red] - ( 0,06 p / n) pH
Pour des concentrations données de [Ox] et [Red] le potentiel dépend linéairement du pH
Conséquence : Possibilité d'inversion des réactions
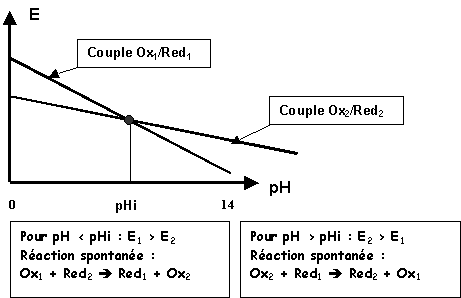
Utilisation de E0
'pH = E0 apparent pour un pH donnéE = E0 + (0,06 / n) log [Ox] / [Red] - ( 0,06 p / n) pH
E = E0 - ( 0,06 p / n) pH
+ (0,06 / n) log [Ox] / [Red]E = E0'pH + (0,06 / n) log [Ox] / [Red]
En utilisant ce potentiel de référence apparent pour un pH donné les ions H3O+ sont automatiquement pris en compte et on ne les mettra donc pas dans les expressions du potentiel de Nernst.
Remarque : En biochimie et biologie on est très souvent dans les conditions standards biologiques et donc pH=7. On utilise donc E0'7 mais on n'indique pas le 7 qui est sous entendu et on écrit simplement E0'.