P.C.E.M : PHYSICO-CHIMIE 3 - Oxydoréduction - Tampon -Thermo
Toutes les données sont pour T = 300 K.
Pour simplifier les calculs on prendra R =
8 J.mol-1.K-1 et à 300 K :
2,3 RT/F = 0,06 J.C-1 et 2,3 R T
= 6000 J.mol-1
Pour le couple : ClOH (aq) = ClO-(aq)
+ H+(aq) on donne
: pKa = 7,0
Pour le couple : a ClOH (aq) + b
H+(aq) + c e-
= d Cl-(aq) + e
H2O on donne : E01
= 1,40 V
Pour le couple Fe3+(aq)/Fe2+(aq)
on donne E02 = 0,80 V
Pour le couple I2(aq)/I-(aq) on donne E03 = 0,54 V
1) Pour la
réaction : ClOH (aq) = H+(aq) + ClO-(aq)
à T = 300 K, la variation d'enthalpie libre de réaction est de :
on prendra 2,3 R T = 6000 J.mol-1
A : DRG0
(300) = 42 KJ.mol-1- B : DRG0
(300) = -42 KJ.mol-1 - C : DRG0
(300) = -22 KJ.mol-1
D : DRG0
(300) = 22 KJ.mol-1 - E : DRG0
(300) = 52 KJ.mol-1
DRG0 = - R T ln K
DRG0 = - 2,3 R T log K
DRG0 = - 2,3 * 8 * 300 * log 10-7 = -
6000 * -7 = 42000 J.mol-1 = 42 kJ.mol-1
A : DRG0
(300) = 42 KJ.mol-1
Soit l'équilibre chimique : a Cl-(aq)
+ b Fe3+(aq) + c H2O(l) = d H+(aq)
+ e ClOH (aq) + f Fe2+(aq)
2)
La constante KR de cet équilibre est :
On prendra : 2,3 RT/F =
0,06 J.C-1
Réponse A : KR(300)
= 1030 - Réponse B : KR(300) = 10-30 - Réponse
C : KR(300) = 1020
Réponse D : KR(300) = 10-20 - Réponse E : KR(300) = 105
Qualitativement :
Cl-(aq)
+ H2O(l) = ClOH (aq) + H+(aq) + 2 e-
Fe3+(aq) + e- = Fe2+(aq)
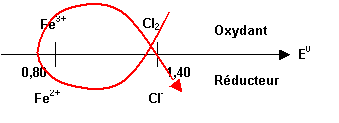
DE0
= 1,4 – 0,8 = 0,6 V
DE0
> 0,3 V è Réaction spontanée quasi-totale
La
réaction proposée est la réaction inverse, sa constante d’équilibre sera donc
très faible.
Quantitativement :
(1) Couple Réducteur : Cl-(aq)
+ H2O(l) =
ClOH (aq) + H+(aq)
+ 2 e-
DRG01 = 2 F E01
(2) Couple Oxydant :
2 * { Fe3+(aq) +
e- = Fe2+(aq) }
DRG02 = - F E02
(3)
Réaction : Cl-(aq) + 2
Fe3+(aq) + H2O(l)
= H+(aq) + ClOH (aq) + 2 Fe2+(aq)
DRG03 = - RT ln K
(3)
= (1) + 2 * (2)
DRG03 = DRG01 + 2 DRG02
- RT ln K = 2 F E01+ 2 * - F E02
RT/F ln K = -2 E01+
2 * E02
RT/F ln K = 2 * (
E02 – E01)
2,3 RT/F log K = 2
* ( E02 – E01)
0,06 log K = 2 *
( 0,80 – 1,40)
log K = 2 * -0,6
/ 0,06 = - 20
Réponse D : KR(300) =
10-20
3)
On mélange initialement 0,02 mole de Fe2+(aq) , 0,015
mole de Fe3+(aq) , 0,02 mole de Cl-(aq)
et 0,03 mole de ClOH(aq). Le pH de la solution est fixé à pH = 5
grâce à une solution tampon. Le volume total du mélange réalisé est de V = 1 L.
Une fois l'équilibre réalisé les molarités
des diverses espèces chlorées seront :
Réponse A : Cl-(aq) = 0,03 mol.L-1 - ClOH(aq)
= 0,02 mol.L-1 - ClO-(aq)
= 0,01 mol.L-1
Réponse B : Cl-(aq) = 0,025 mol.L-1 - ClOH(aq) = 0,03 mol.L-1 - ClO-(aq) = 5
10-12 mol.L-1
Réponse C : Cl-(aq) = 0,002 mol.L-1 - ClOH(aq) = 0,06 mol.L-1 - ClO-(aq) = 4
10-5 mol.L-1
Réponse D : Cl-(aq)
= 0,03 mol.L-1 - ClOH(aq) = 0,02 mol.L-1 - ClO-(aq) = 2
10-4 mol.L-1
Réponse E : Cl-(aq) = 0,05 mol.L-1 - ClOH(aq) = 0,02 mol.L-1 - ClO-(aq) = 2
10-3 mol.L-1
Cl-(aq)
+ 2 Fe3+(aq)
+ H2O(l) = H+(aq) + ClOH (aq) + 2 Fe2+(aq)
K
= 10-20 : Réaction négligeable
H+(aq)
+ ClOH (aq) + 2 Fe2+(aq) = Cl-(aq) + 2
Fe3+(aq) + H2O(l)
K
= 1020 : Réaction totale
|
|
H+(aq) |
ClOH (aq) |
2 Fe2+(aq) |
Cl-(aq) |
2 Fe3+(aq) |
H2O(l) |
|
Etat Initial |
10-5 |
0,03 (Excès) |
0,02 (défaut) |
0,02 |
0,015 |
Excès |
|
Etat Final |
10-5 |
0,03 – 0,02/2 0,02 |
0 |
0,02 + 0,02/2 0,03 |
0,015 + 0,02 0,035 |
Excès |
Au vu de ce
tableau seules les réponses A et D sont possibles.
Pour choisir
il faut calculer [ClO-(aq)]
pH = pKa + log
[base] / [acide]
log [base] /
[acide] = log R = pH - pKa
log R = 5 – 7 = -2
R = [base] /
[acide] = 0,01
[base] =
R * [acide] = 0,01 [acide]
[ClO-(aq)]
= [ClOHaq)] * 0,01 = 0,02 * 0,01 = 2 10-4 mol.L-1
Réponse D : Cl-(aq)
= 0,03 mol.L-1 - ClOH(aq) = 0,02 mol.L-1 - ClO-(aq) = 2
10-4 mol.L-1
3) On veut
préparer un litre de solution tampon de pH = 7 à partir d'une solution S1
de ClOH(aq) à 0,1 mol.L-1 et d'une solution aqueuse S2
de soude (Na+,OH-) à C2 mole.L-1.
Pour cela on
mélange 500 mL de S1 à 500 mL de S2.
La solution S2
de soude doit avoir pour molarité :
Réponse A : C2
= 0,025 mol.L-1 - Réponse B : C2 = 0,030 mol.L-1
Réponse C : C2 = 0,050 mol.L-1 - Réponse D : C2 = 0,0125 mol.L-1
Réponse E : C2
= 0,015 mol.L-1
HClO+ OH-
è
ClO- + H2O
Espèces
présentes : HClO ; ClO- ; Na+ ; H3O+
: OH-
R = [base] /
[acide]
pH = pKa + log
R
log R = pH -
pKa
log R = 7 - 7
= 0 è
R = 100 = 1
[base] =
[acide]
[ClO-]
= [HClO]
C.M : [ClO-]
+ [HClO] = C1 V1 / ( V1 + V2 ) =
0,1 * 500 / 1000 = 0,05 mol.L-1
[ClO-]
= [HClO] = 0,025 mol.L-1
[Na+]
= C2 V2 / ( V1 + V2 ) = C2
* 500 / 1000 = 0,5 C2 mol.L-1
E.N : [Na+]
+ [H3O+] = [ClO-] + [OH-]
[Na+]
= [ClO-] + [OH-]-[H3O+]
0,5 C2
= 0,025 + 10-9 + 10-5 » 0,025
C2
= 0,025 / 0,5 = 0,005 mol.L-1
Réponse C : C2 = 0,050 mol.L-1
Remarque : Manière plus rapide de résolution
pH = pKa on
est proche de la 1/2 neutralisation
Au Point
Equivalent : C1 V1 = C2 V2
Au 1/2 Point
Equivalent : 1/2 C1 V1 = C2 V2
1/2 C1
V1 = C2 V2
C2=
1/2 C1 V1 / V2
C2=
1/2 0,1 * 500 / 500 = 0,05 mol.L-1
4)
On réalise à pH = 0, le titrage de V1 = 25 mL d'une solution de I-(aq)
de molarité C1 inconnue par une solution de ClOH(aq) de
molarité C2 = 0,05 mol.L-1. Il faut verser V2
= 12,5 mL de cette solution de ClOH(aq) pour atteindre le point équivalent du titrage. La molarité C1
de la solution de I-(aq) est de :
Réponse A : C1 = 0,050 mol.L-1 - Réponse B : C1 = 0,020 mol.L-1
Réponse C : C1
= 0,025 mol.L-1 - Réponse D : C1 = 0,060 mol.L-1
Réponse E : C1
= 0,030 mol.L-1
(1) 2 I-
= I2 + 2 e-
nI-
= 1
N1
= C1
(2)
HClO (aq) + H+(aq)
+ 2 e -= Cl-(aq) + H2O(l)
nHClO
= 1
N2
= 2 C2
N1
V1 = N2 V2
C1
V1 = 2 C2 V2
C1
= 2 C2 V2 / V1
C1
= 2 * 0,05 * 12,5 / 25 = 0,1 * 12,5 / 25 = 1,25 / 25 = 0,05 mol.L-1
Réponse A : C1 = 0,050 mol.L-1
5) Les nombres
d'oxydation des atomes de Chlore sont :
Réponse A : +
IV dans ClOH et + V dans ClO-
Réponse B : -
III dans ClOH et - III dans ClO-
Réponse C : + I dans ClOH et + I dans ClO-
Réponse D : -
II dans ClOH et - II dans ClO-
Réponse E : +
III dans ClOH et + I dans ClO-
ClOH : x -2 +
1 = 0 è
x = 1 è
Cl ( + I )
ClO-
: x - 2 = -1 è x = 1 è Cl ( + I )
Réponse C : + I dans ClOH et + I dans ClO-