P.L.P.2 MATH-SCIENCES
DEVOIR DE CHIMIE : LE DIOXYDE DE CARBONE
Exercice 1 :
Il existe deux oxydes de carbone différents :
Dioxyde de Carbone et Monoxyde de Carbone
1) Généralités :
-1a) Donner leurs formules chimiques
-1b) Tous deux sont des gaz toxiques mais l’un est beaucoup plus dangereux que l’autre. Préciser lequel et dire pourquoi il est si dangereux.
2) Synthèse :
Ces deux gaz peuvent être obtenus par combustion du carbone dans l’air ou dans le dioxygène.
-2a) Ecrire les réactions correspondantes.
-2b) Dans la pratique seul l’un des deux est étudié en classe. Lequel ?
Décrivez le protocole expérimental de sa synthèse en classe.
Vous préciserez le matèriel utilisé et vous décrirez sommairement l’expèrience que pourrait réaliser les élèves.
2c) Ce gaz peut être caractérisé par un test très simple. Lequel ? Vous décrirez l’expèrience correspondante et vous écrirez les diverses réactions permettant sa caractérisation.
2d) L’autre est souvent synthétisé involontairement et est cause de nombreux décès accidentels. Vous préciserez dans quelles circonstances il est ainsi produit accidentellement et vous préciserez les précautions à prendre pour limiter les risques encourus.
3) Chimie théorique - Atomistique :
3a) Donner en justifiant votre réponse les schémas de Lewis de ces deux molècules et leur géomètrie. Indiquez de même structure de Lewis et géomètrie de l’ion Carbonate.
4) Dioxyde de Carbone en solution aqueuse :
Le dioxyde de carbone est soluble dans l’eau. La solution obtenue est acide.
4a) Sachant qu’il s’agit d’un diacide faible écrire les réactions qui se produisent lors de sa dissolution.
4b) Donner l’expression des constantes d’équilibre correspondantes.
Montrer comment on peut calculer le pH d’une solution aqueuse de ce gaz si ces constantes sont connues.
5) Dioxyde de carbone dans l’atmosphère :
L’air qui nous entoure contient naturellement du dioxyde de carbone.
5a) Citer les principales causes naturelles de sa production et donc se sa présence dans l’atmosphère.
5b) Sa teneur à longtemps été considérée comme constante. Une méthode de datation est d’ailleurs basée sur cette hypothèse. Décrivez simplement cette technique.
5c) Cette teneur est-elle toujours constante aujourd’hui ? Pourquoi ? Quelle conséquences possibles cela pourrait-il entrainer dans l’ avenir ?
6) Conséquences pratiques
6a) L’eau distillée n’ a généralement pas un pH neutre. Pourquoi ?
6b) Les solutions de soude ne se conservent pas très bien et à la longue on observe la précipation d’un solide blanc au fond des flacons qui les contiennent. Quel est ce solide ? Ecrire les réactions qui le produisent.
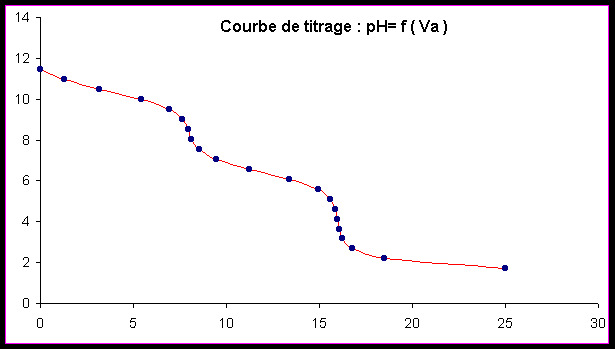
Exercice 2 : Titrage pH-mètrique du carbonate de sodium
On titre par pH-métrie 20 ml d’une solution de carbonate de sodium par l’acide chlorhydrique 0,1 M.
2a) Donner l’expression théorique permettant le calcul du pH en fonction du volume d’acide versé pour les différents domaines de la courbe de titrage.
2b) A partir de la courbe expérimentale déterminer :
- la concentration de la solution.
- les pKa du carbonate de sodium.
