PARTIE A : LE DIOXYDE DE SOUFRE ET SA SOLUTION AQUEUSE
A-1 : Donner la configuration électronique des atomes de soufre et d'oxygène
Le soufre naturel est un mélange de trois isotopes 32S, 34S et 33S. La masse molaire du mélange naturel est de de 32,06 g.mol-1
A-2 : Donner la "composition" du noyau de chaque isotope.
Sachant que l'abondance naturelle de l'isotope 32S est de 95,1%.
A-3-1 : évaluer approximativement l'abondance naturelle des deux autres isotopes.
A-3-2 : Quelles données supplémentaires seraient nécéssaires pour un calcul exact de ces abondances ?
Il existe également un isotope radioactif 35S
A-4-a : De quel type d'emetteur radiaoctif cet isotope fait-il partie ?
A-4-b : Ecrire la tranformation radioactive correspondante.
A-5 : Le dioxyde de soufre SO2
A-5-1 : Donner le schéma de Lewis de cette molécule.
A-5-2 : En utilisant la méthode de Gillespie (V.S.E.P.R) prévoir sa géométrie et en donner une représentation spatiale.
A-5-3 : Préciser la valeur attendue pour les angles OSO.
A-5-4 : Que signifie le sigle V.S.E.P.R ? En donner la traduction française.
A-6 : L'ion sulfite SO32-
Dissous dans l'eau en milieu basique, le dioxyde de soufre se transforme en ion sulfite SO32-.
A-6-1 :Donner le schéma de Lewis de cet ion moléculaire.
A-6-2 : En utilisant la méthode de Gillespie (V.S.E.P.R) prévoir sa géométrie et en donner une représentation spatiale.
A-6-3 : Préciser la valeur attendue pour les angles OSO.
A-7 : L'acide sulfureux H2SO3
Dissous dans l'eau en milieu acide, le dioxyde de soufre se transforme en acide sulfureux H2SO3.
A-7-1 :Donner le schéma de Lewis de cette molécule.
A-7-2 : En utilisant la méthode de Gillespie (V.S.E.P.R) prévoir sa géométrie et en donner une représentation spatiale.
A-7-3 : Préciser la valeur attendue pour les angles OSO et SOH.
A-8 : La solution aqueuse de H2SO3
L'acide sulfureux est un diacide dont les valeurs de pKa sont : pK1=1,8 et pK2=7,2
A-8-1 : Ecrire les deux réactions et définir les deux constantes d'acidité K1 et K2
A-8-2 : Ecrire les diverses relations qui permettent de calculer le pH d'une solution aqueuse de H2SO3 de concentration C mol.L-1.
Le calcul du pH est possible sans faire aucune approximations mais pour simplifier le problème les chimistes ont pris l'habitude de faire quelques approximations raisonnables.
La première approximation classique dans ce type de problème est de ne tenir compte que de la première acidité de H2SO3 et donc de négliger la seconde.
A-8-5 : Dans le cadre de cette première approximation classique montrer les simplifications qui en découlent dans les diverses équations etablies précédemment.
A-8-6: Le problème restant relativement complexe, on cherche à le simplifier à nouveau. Pour cela on suppose que la solution est suffisement acide pour pouvoir négliger la présence d'ions hydroxyde. Que deviennent alors les équations précédantes ?
A-8-7 : Résoudre le problème dans ce cadre et calculer le pH de la solution pour C=0,01 mol.L-1.
A-8-8 : Calculer ensuite pour le pH trouvé les concentrations de toutes les espèces présentes en solution et vérifier ainsi la validité des deux aproximations faites.
A-8-9 : On aurait pu simplifier encore plus le problème en supposant que la première acidité de H2SO3 est suffisament faible pour que l'on puisse négliger sa dissociation.
Quelle formule classique obtient-on dans ce cadre ? Cette formule simplifiée est-elle valable dans le cas qui nous interesse si on veut pH à 0,1 unité près ?
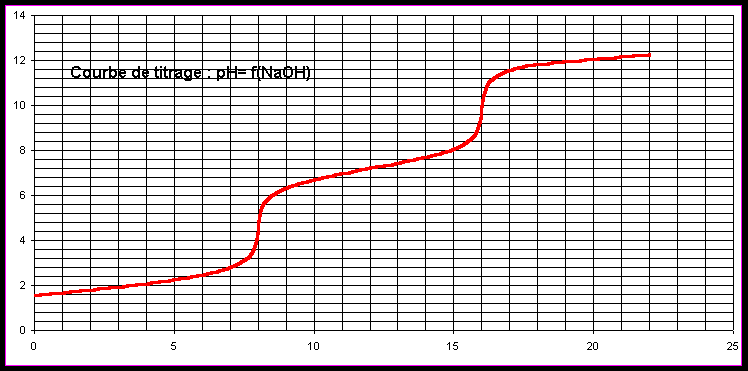
A-9 : Titrage de l'acide sulfureux par la soude
La courbe de titrage pH-métrique de 20 mL d'une solution de H2SO3 de molarité inconnue par de la soude à 0,1 mol.L-1 vous est fournie en annexe.
A-9-1 : Quelle est la molarité de H2SO3 ?
A-9-2 : Quel est le pH au premier point équivalent ?
Etablir la relation qui permet de le calculer et vérifier l'accord avec la courbe fournie.
A-9-3 : Quel est le pH au deuxième point équivalent ?
Etablir la relation qui permet de le calculer et vérifier l'accord avec la courbe fournie.

PARTIE B : ETUDE D'UN TITRAGE
On réalise le titrage de Va mL d'une solution aqueuse de A de molarité Ca par une solution aqueuse de B de molarité Cb.
La réaction de titrage est la suivante : 2 A(aq) + 3 B(aq) = A2B3(s)
La détermination du point équivalent du titrage se fait par utilisation d'un indicateur coloré bien choisi. On donne log KR = 30 pour cette réaction.
On suppose que l'on verse progressivement la solution de B dans la solution de A.
B-1: Donner un schéma légendé du montage utilisé en pratique pour ce titrage.
B-2 : Décrire un protocole opératoire clair en précisant bien le matériel utilisé.
B-3 : Etablir les relations qui permettent de tracer la courbe de titrage :
pA = -log [A] = f(Vb)
On pourra pour simplifier le problème faire une (des) approximation(s) que l'on justifiera.
B-4 : Tracer cette courbe pour Ca=0,015 mol.L-1 Va = 20 mL et Cb=0,025 mol.L-1
B-5 : A quelle condition doit satisfaire l'indicateur pour pouvoir être utilisé pour ce titrage.