MASS - MIAS - S.M 1 - Session de Décembre 2001 -
" Initiation à la Chimie Théorique "
Première période : "Les Atomes"
CORRIGE
DONNEES :
C = 3 108 m.s-1 - h = 6,62 10-34 J.s - e = 1,6 10-19 C - E0 = 13,6 eV = 2,18 10-18 J
Règle de Sanderson : "un élément est métallique si le nombre d'électrons sur sa couche de n le plus élevé est inférieur ou égal au numéro de sa période."
Exercice 1 : Le spectre de l'atome d'hydrogène comporte une raie violette correspondant à une longueur d'onde de 411 nm.
Séries de raies pour l'atome d'Hydrogène :
n |
1 |
2 |
3 |
4 |
Nom |
Lyman |
Balmer |
Paschen |
Bracket |
Domaine spectral |
U.V |
Visible |
I.R |
I.R |
1) A quelle série appartient cette raie ?
l = 411 nm = domaine du visible (raie violette) = Série de Balmer
2) Calculer sa fréquence et son énergie.
n = C / l = 3 108 / 411 10-9 = 7,3 1014 Hz
E = h n = 6,62 10-34 * 7,3 1014 = 4,83 10-19 J = 3,02 eV
3) A quelle transition électronique n à p cette raie est-elle associée?
DE = E0 ( 1/p2 - 1/ n2 )
Série de Balmer è p = 2
DE = E0 ( 1/4 - 1/ n2 )
3,02 = 13,6 ( 1/4 - 1/ n2 )
3,02 / 13,6 = ( 1/4 - 1/ n2 )
0,222 = ( 1/4 - 1/ n2 )
1/ n2 = 0,25 - 0,222 = 0,028
n2 » 35,8 = 36
n = 6
Transition 6 è 2
Exercice 2 : Soit l'élément situé dans la quatrième ligne et dans la quatorzième colonne de la classification périodique.
1) Quelle est sa configuration électronique ?
Colonne 14 è configuration en ns2 np2
Ligne 4 è n = 4 è 4 s2 4 p2

1s2 - 2s2 - 2p6 - 3s2 - 3p6 - 4s2 - 3d10 - 4p2
= (Ar) 3d10 - 4s2 - 4p2
2) Quel est son numéro atomique ?
Z = 18 + 10 + 2 + 2 = 32
3) D'après la règle de Sanderson, cet élément est-il un métal ?
4 électrons sur sa couche de n le plus élevé et appartient à la période 4 : c'est un métal d'après la règle de Sanderson.
Exercice 3 : On à demandé à deux étudiants de représenter la classification périodique des éléments, voici le résultat de leur réflexion.
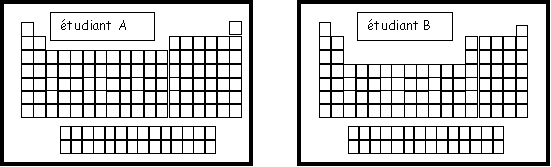
On demande de corriger leur(s) éventuelle(s) erreur(s) en justifiant simplement la réponse.
Etudiant A :
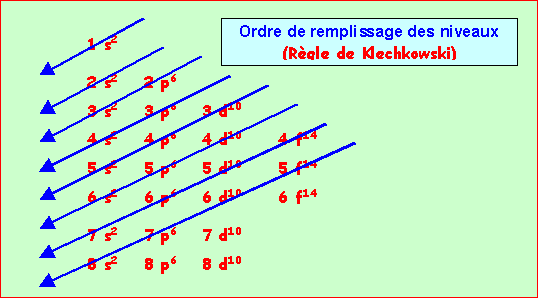
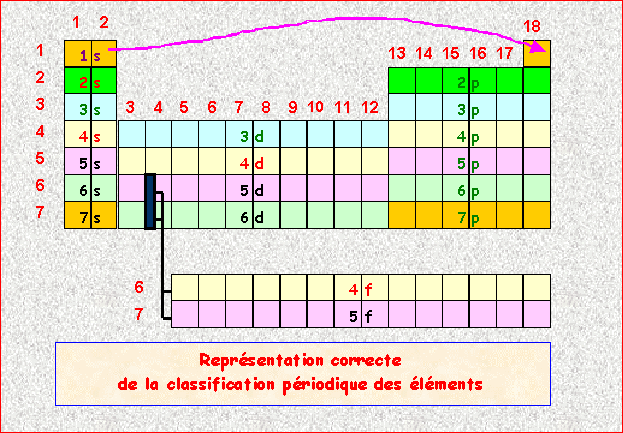
Le bloc d n'intervient qu'a partir de la quatrième ligne et non de la troisième car dans l'ordre de Klechkowski 3d n'apparaît qu'après 4s.
Etudiant B :
Il manque une colonne dans le bloc p (5 cases au lieu de 6)
Exercice 4 :
Complétez les phrases a l'aide des mots ou expressions suivants :
Alred et Rochow - azimutal - Bohr - couche - hydrogénoïde - isotope - Mulliken - noyau - petit - principal - protons - secondaire - Slater
Un élément se caractérise par le nombre de protons contenu dans son noyau.
Un isotope est caractérisé par le nombre de protons et le nombre de neutrons contenu dans le noyau.
Le nombre quantique principal est un nombre entier non nul qui caractérise la couche occupée par l'électron.
Le nombre quantique secondaire ou azimutal caractérise la sous-couche qu'occupe l'électron.
Le modèle de Slater permet d'assimiler un atome polyélectronique à un atome hydrogénoïde pour lequel on pourra appliquer le modèle de Bohr.
Plus le rayon atomique est petit et plus l'énergie d'ionisation est importante.
Dans l'échelle de Alred et Rochow l'électronégativité est proportionnelle à la force d'attraction électrostatique de Coulomb.
Dans l'échelle de Mulliken l'électronégativité est proportionnelle à la somme energie de première ionisation + électroaffinité