MASS - MIAS - S.M 1 - Session de Décembre 2001 -
" Initiation à la Chimie Théorique "
Première période : "Les Atomes"
DONNEES :
C = 3 108 m.s-1 - h = 6,62 10-34 J.s - e = 1,6 10-19 C - E0 = 13,6 eV = 2,18 10-18 J
Règle de Sanderson : "un élément est métallique si le nombre d'électrons sur sa couche de n le plus élevé est inférieur ou égal au numéro de sa période."
Exercice 1 : Le spectre de l'atome d'hydrogène comporte une raie violette correspondant à une longueur d'onde de 411 nm.
Séries de raies pour l'atome d'Hydrogène :
n |
1 |
2 |
3 |
4 |
Nom |
Lyman |
Balmer |
Paschen |
Bracket |
Domaine spectral |
U.V |
Visible |
I.R |
I.R |
1) A quelle série appartient cette raie ?
2) Calculer sa fréquence et son énergie.
3) A quelle transition électronique n à p cette raie est-elle associée?
Exercice 2 : Soit l'élément situé dans la quatrième ligne et dans la quatorzième colonne de la classification périodique.
1) Quelle est sa configuration électronique ?
2) Quel est son numéro atomique ?
3) D'après la règle de Sanderson, cet élément est-il un métal ?
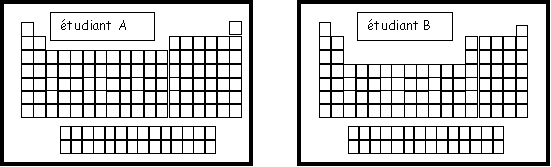
Exercice 3 : On à demandé à deux étudiants de représenter la classification périodique des éléments, voici le résultat de leur réflexion.

On demande de corriger leur(s) éventuelle(s) erreur(s) en justifiant simplement la réponse.
Exercice 4 :
Complétez les phrases a l'aide des mots ou expressions suivants :
Alred et Rochow - azimutal - Bohr - couche - hydrogénoïde - isotope - Mulliken - noyau - petit - principal - protons - secondaire - Slater
Un élément se caractérise par le nombre de ----------------------- contenu dans son---------------------- .
Un --------------------------est caractérisé par le nombre de protons et le nombre de neutrons contenu dans le noyau.
Le nombre quantique ------------------------------est un nombre entier non nul qui caractérise la -----------------------occupée par l'électron.
Le nombre quantique -----------------------ou -----------------------caractérise la sous-couche qu'occupe l'électron.
Le modèle de -----------------------permet d'assimiler un atome polyélectronique à un atome -----------------------pour lequel on pourra appliquer le modèle de -----------------------.
Plus le rayon atomique est -----------------------et plus l'énergie d'ionisation est importante.
Dans l'échelle de -----------------------l'électronégativité est proportionnelle à la force d'attraction électrostatique de Coulomb.
Dans l'échelle de -----------------------l'électronégativité est proportionnelle à la somme énergie de première ionisation + électroaffinité