DEUG STPI - Première année - U.E.2 - "Réaction chimique"
Session de Décembre 2001 - CORRIGE
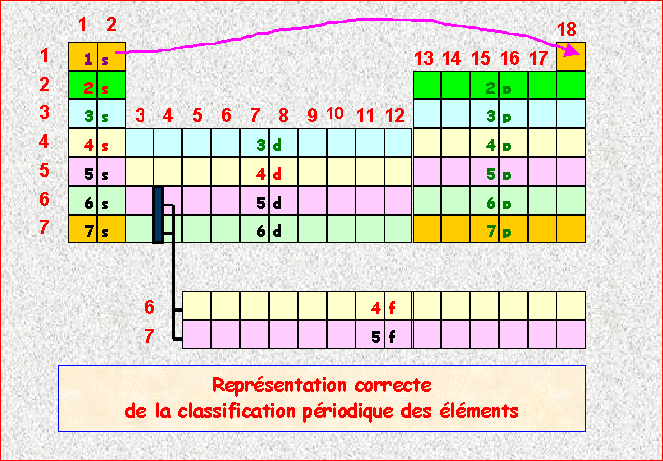
Exercice 1 :
C = 3 108 m.s-1 - h = 6,62 10-34 J.s - e = 1,6 10-19 C - E0 = 13,6 eV = 2,18 10-18 J
Le spectre de l'atome d'hydrogène comporte une raie violette correspondant à une longueur d'onde de 411 nm.
Séries de raies pour l'atome d'Hydrogène :
n |
1 |
2 |
3 |
4 |
Nom |
Lyman |
Balmer |
Paschen |
Bracket |
Domaine spectral |
U.V |
Visible |
I.R |
I.R |
l = 411 nm = domaine du visible (raie violette) = Série de Balmer
Calculer sa fréquence et son énergie.
n = C / l = 3 108 / 411 10-9 = 7,3 1014 Hz
E = h n = 6,62 10-34 * 7,3 1014 = 4,83 10-19 J = 3,02 eV
2) A quelle transition électronique n à p cette raie est-elle associée?
DE = E0 ( 1/p2 - 1/ n2 )
Série de Balmer è p = 2
DE = E0 ( 1/4 - 1/ n2 )
3,02 = 13,6 ( 1/4 - 1/ n2 )
3,02 / 13,6 = ( 1/4 - 1/ n2 )
0,222 = ( 1/4 - 1/ n2 )
1/ n2 = 0,25 - 0,222 = 0,028
n2 » 35,8 = 36
n = 6
Transition 6 è 2
Exercice 3 : MPb= 207,2 g.mol-1 - MCl = 35,5 g.mol-1
Soit la réaction : Pb2+ (aq) + 2 Cl- (aq) = PbCl2 (s)
Pour déterminer la constante KR de cette réaction de précipitation du chlorure de plomb on procède a deux expériences différentes :
Expérience 1 : On introduit dans un bécher 20 mL d'une solution d'acétate de plomb (Pb2+ ; 2 CH3COO-) de concentration molaire 0,1 mol.L-1 et 20 mL de solution de chlorure de sodium ( Na+ ; Cl-) de concentration molaire 0,2 mol.L-1. On laisse la réaction se faire puis on filtre le contenu du bécher de manière à récupérer le solide formé. Après lavage et séchage du solide on pèse celui-ci et on trouve une masse de précipité de PbCl2 (s) : m = 0,3811 g. Calculer KR.
Nombre de mole initial de Pb2+ : 20 * 0,1 / 1000 = 2 10-3 mole
Nombre de mole initial de Cl- : 20 * 0,2 / 1000 = 4 10-3 mole
Pb2+ (aq) + 2 Cl- (aq) = PbCl2 (s)
Pb2+ (aq) |
Cl- (aq) |
PbCl2 (s) |
|
E.I |
2 10-3 |
4 10-3 |
0 |
E.F |
2 10-3 - x |
4 10-3 - 2 x |
x |
Nombre de mole de PbCl2 (s)
x = 0,3811 / (207,2+2*35,5) =0,3811 / 278,2 = 1,37 10-3
Nombre de mole final de Cl- :
4 10-3 - 2 x = 4 10-3 - ( 2 x 1,37 10-3 ) = 1,26 10-3 mole
Molarité de Cl-: 1,26 10-3 / 40 10-3 = 0,0315 mol.L-1
Nombre de mole final de Pb2+ : 2 10-3 - x = 2 10-3 - 1,37 10-3 = 6,3 10-4 mole
Molarité de Pb2+ : 6,3 10-4 / 40 10-3 = 0,01575 mol.L-1
Calcul de KR :
KR = a PbCl2 (s) / a Pb2+ (aq) / a2 Cl- (aq)
KR = 1/ [Pb2+] / [Cl-]2
KR = 1/ 0,01575 / 0,03152 = 63988
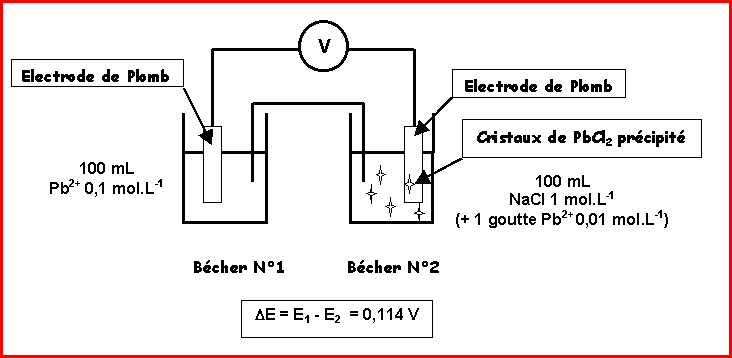
Expérience 2 :
On réalise la pile suivante (voir schéma)

a) Exprimer le potentiel de l'électrode 1 sachant que le couple d'oxydoréduction est le couple
Pb2+(aq) / Pb(s).
Pb2+ + 2e- = Pb
E1 = E0 + 0,03 log [Pb2+]1
b) Exprimer le potentiel de l'électrode 2 sachant que le couple d'oxydoréduction est le couple
Pb2+(aq) / Pb(s).
Pb2+ + 2e- = Pb
E2 = E0 + 0,03 log [Pb2+]2
c) Exprimer la différence de potentiel de la pile DE = E1 - E2
E1 = E0 + 0,03 log [Pb2+]1
E2 = E0 + 0,03 log [Pb2+]2
DE = E1 - E2 = 0,03 log [Pb2+]1 - 0,03 log [Pb2+]2
DE = 0,03 { log [Pb2+]1 - log [Pb2+]2 }
d) Sachant que DE = E1 - E2 = 0,114 V, calculer la concentration de l'ion Pb2+ dans le bécher N°2.
DE = 0,03 { log [Pb2+]1 - log [Pb2+]2 }
DE / 0,03 = { log [Pb2+]1 - log [Pb2+]2 }
log [Pb2+]2 = log [Pb2+]1 - DE / 0,03
log [Pb2+]2 = log 0,1 - ( 0,114 / 0,03 ) = -4,8
[Pb2+]2= 1,585 10-5 mol.L-1
e) En supposant que la concentration des ions Cl- dans le bécher N°2 n'a pas été modifiée par l'ajout de Pb2+, calculer KR.
KR = 1/ [Pb2+] / [Cl-]2
KR = 1/ 1,585 10-5 / 0,12 = 63096
Exercice 5 :
Fe3+ / Fe : E01 = 0,77 V - HNO3 / NO(g) : E02 = 1,05 V
R = 8,31 J. mol-1 .K-1 - 1 bar = 105 Pa - MFe = 56 g.mol-1
Le fer est oxydé en ions ferriques Fe3+ par l'acide nitrique concentré HNO3 qui est lui même réduit en monoxyde d'azote NO (composé gazeux).
1) Ecrire et équilibrer la réaction.
Fe = Fe3+ + 3 e-
HNO3 + 3 H+ + 3 e- = 2 H2O + NO
Fe + HNO3 + 3 H+ = Fe3+ + 2 H2O + NO
ou : Fe + 4 HNO3 = Fe3+ + 2 H2O + NO + 3 NO3-
2) Calculer sa constante d'équilibre. Conclusion ?
Fe = Fe3+ + 3 e-
E1 = E01 + 0,02 log [Fe3+]
HNO3 + 3 H+ + 3 e- = 2 H2O + NO
E2 = E02 + 0,02 log { [HNO3] [H+]3 / PNO }
Fe + HNO3 + 3 H+ = Fe3+ + 2 H2O + NO
KR = PNO [Fe3+] / [HNO3] [H+]3
On a E1 = E2 :
E01 + 0,02 log [Fe3+] = E02 + 0,02 log { [HNO3] [H+]3 / PNO }
0,02 log [Fe3+] - 0,02 log { [HNO3] [H+]3 / PNO } = E02 - E01
0,02 log [Fe3+] + 0,02 log { PNO / [HNO3] [H+]3 } = E02 - E01
0,02 log { [Fe3+] PNO / [HNO3] [H+]3 } = E02 - E01
0,02 log KR = E02 - E01
log KR = ( E02 - E01 ) / 0,02 = ( 1,05 - 0,77 ) / 0,02 = 14
KR = 1014
La réaction peut être considérée comme totale.
3) On attaque 20 g de fer en poudre par un large excès de HNO3. Quel volume de gaz NO pourra-t-on recueillir sous 1,5 bar à 35°C ?
Fe + HNO3 + 3 H+ = Fe3+ + 2 H2O + NO
n0 Fe = 20 / 56 = 0,357
HNO3 (et donc H+) sont en excès.
On obtiendra donc 0,357 mole de NO.
PV = n R T
V = n R T / P = 0,357 * 8,314 * (273 + 35 ) / 1,5 105 = 6,09 10-3 m3 = 6,09 L
Exercice 4 : On à demandé à deux étudiants de représenter la classification périodique des éléments, voici le résultat de leur réflexion.
On demande de corriger leur(s) éventuelle(s) erreur(s) en justifiant simplement la réponse.
Etudiant A :
Le bloc d n'intervient qu'a partir de la quatrième ligne et non de la troisième car dans l'ordre de Klechkowski 3d n'apparaît qu'après 4s.
Etudiant B :
Il manque une colonne dans le bloc p (5 cases au lieu de 6)