Thierry
Briere : http://www.chimie-briere.com
Première année : SM-SV-ST-GP - EXAMEN – Session de Rattrapage 2005
ATOMES
ET MOLECULES
LES GAZ RARES : CORRIGE
Toutes
les réponses devront être justifiées clairement , une réponse non justifiée ne
sera pas prise en compte. Tous les exercices
sont indépendants.
1
eV = 1,602 ´ 10 –19 J
célérité de la
lumière dans le vide : C = 2,998 ´ 10 8 m.s
–1
Constante
d'Avogadro NA = 6,02 ´ 10 23 mol –1
Force
de Coulomb : f = K qq’/d2
avec K = 1/(4p e0)
) = 9 109 m.F-1
Energie
d’ionisation de H : 13,6 eV = 2,18 10-18 J
Constante
de Planck : h = 6,62 10-34 J.s
Accélération
de la pesanteur : g = 9,806 m.s-2
Charge du proton : e =
1,6 10-19 C
|
entités |
masse
en kg |
entités |
masse
en kg |
|
Neutron |
1,674 927 ´ 10 –27 |
Noyau |
6,644 65 ´ 10 –27 |
|
électron |
9,11 10-31 |
Noyau 226 Ra |
3,752 438 ´ 10 –25 |
|
Proton |
1,672 621 ´ 10 –27 |
Noyau 222 Rn |
3,685 904 ´ 10 –25
|
Effets d’écran de Slater :
|
1s |
0,3 |
|
|
|
|
|
|
2s
2p |
0,85 |
0,35 |
|
|
|
|
|
3s
3p |
1 |
0,85 |
0,35 |
|
|
|
|
3d |
1 |
1 |
1 |
0,35 |
|
|
|
4s
4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
|
|
4d |
1 |
1 |
1 |
1 |
1 |
0,35 |
|
|
1s |
2s
2p |
3s
3p |
3d |
4s
4p |
4d |
Exercice 1 : l’Hélium
NOTA : Aucune démonstration des formules utilisées n’est exigée. On pourra utiliser directement les résultats du modèle de Bohr sans démonstrations.
On
considère l’espèce symbolisée par ![]() He+
He+
Dans l’état fondamental, le rayon de
l’orbite de Bohr est de 0,27 A°.
1-1)
Déterminer l’intensité de la force de Coulomb s’exerçant sur
l’électron. (0,25 point)
![]() He+ : Ion hydrogénoïde possédant un électron unique, le
modèle de Bohr s’applique donc.
He+ : Ion hydrogénoïde possédant un électron unique, le
modèle de Bohr s’applique donc.
F = K q q’ / d2
K = 1/(4p e0) ) = 9 109 m.F-1
q = charge du noyau = 2 e = 2 * 1,6 10-19
= 3,2 10-19 C
q’ = charge de l’électron = e = 1,6 10-19
C
d = rayon de Bohr = 0,27 10-10
m
F
= 9 109 * 3,2 10-19 * 1,6 10-19 / (0,27 10-10)2
= 6,32 10-7 N
1-2)
Comparez la au poids de l’électron. Conclusion ? (0,25 point)
P = m g = 9,11
10-31 * 9,806 = 8,93 10-30 N
Le poids de l’électron est totalement négligeable par rapport à la force de coulomb.
1-3)
Déterminer la vitesse de l’électron sur son orbite. (0,25 point)
Le plus simple consiste à
utiliser directement le postulat de Bohr :
m V R = n h / (2 p)
V = n h / (2 p m R )
Avec n=1 pour l’état
fondamental
V = h / (2 p m R )
V = 6,62 10-34 / (2 p 9,11 10-31 * 0,27 10-10
) = 4,28 106
m.s-1
On retrouverait le même résultat par
application du théorème fondamental de la dynamique. (Voir le cours)
1-4)
Déterminer l’énergie de l’électron. (0,25 point)
E = - E0
Z2 / n2 = - 4 E0 = -4 * 2,18 10-18 = 8,72 10-18 J
1-5)
1-4) Déterminer
la longueur de l’onde de De Broglie associée à l’électron. (0,25 point)
l = h / p = h / (
m * v ) = 6,62 10-34 / ( 9.11 10-31 * 4,28 106
= 1,698 10-10 m
l = 1,7 A° il serait expérimentalement
possible de mettre en évidence une telle onde.
Exercice
2 : Le Néon
La
molécule Ne2 peut elle exister ? Justifier la réponse par
utilisation du modèle C.L.O.A – O.M. (1 point)
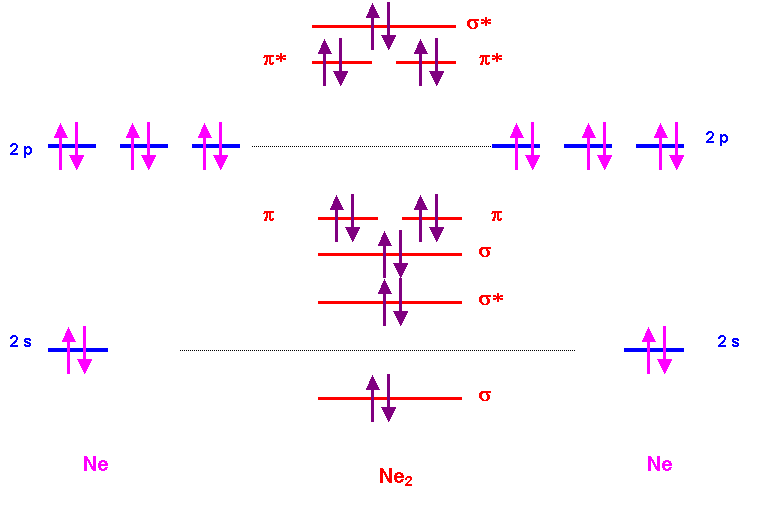
Indice de
liaison :
( 8 – 8 ) / 2 = 0
He2 est moins stable que deux atomes He séparés : He2
n’existe donc pas !
Exercice
3 : L’Argon
Par
utilisation du modèle de Slater évaluer l’énergie de première ionisation de
l’Argon. (2 points)
Ar : Z = 18 :
Groupe de Slater
|
1s2 |
2s2 2p6 |
3s2 3p6 |
Energie
orbitalaire
|
2 E1 |
8 E2 |
8 E3 |
Energie totale de Ar : EAr = 2
E1 + 8 E2 + 8 E3
Ar+ : Z = 18 : 1s2 2s2
2p6 3s2 3p5
Groupe de Slater
|
1s2 |
2s2 2p6 |
3s2 3p5 |
Energie
orbitalaire
|
2 E’1 |
8 E’2 |
7 E’3 |
Energie totale de Ar+ : EAr+
= 2 E’1 + 8 E’2 + 7 E’3
E = -
E0 Z*2 / n2
Si Z*
et n sont identiques les énergies le sont aussi :
E1 = E’1 et E2 = E’2
Energie d’ionisation de Ar :
E.I1 = EAr+ - EAr
E.I1 = 2 E’1 + 8 E’2 + 7
E’3 - 2 E1 - 8 E2 - 8 E3
E.I1 = 7 E’3 - 8 E3
Calcul de E3 :
E = - E0 Z*2 / n2
Z* = 18 – ( 7 * 0,35 ) – ( 8 * 0,85 ) – ( 2 * 1 ) = 6,75
E3 = -13,6 * 6,752 / 9 = -68,85 eV
= 1,102 10-17 J
Calcul de E’3 :
E = - E0 Z*2 / n2
Z* = 18 – ( 6 * 0,35 ) – ( 8 * 0,85 ) – ( 2 * 1 ) = 7,1
E3 = -13,6 * 7,12 / 9 = -76,175 eV
= 1,219 10-17 J
E.I1 = 7 E’3 - 8 E3
E.I1 = ( 7 * -76,175 ) – ( 8 * -68,85 ) = 17,6 eV
E.I1 = 17,6 eV
= 2,81 10-18 J = 1696 kJ.mol-1
Exercice
4 :
Le
Krypton
Le mètre étalon de 1960 était défini par référence
à la longueur d’onde dans le vide du photon émis lors d’une transition de
l’atome de krypton 86, selon cette définition :
1 m = 1650763,73 lraie
4-1)
Quelle est la longueur d’onde de cette raie ? (0,25 point)
lraie = 1 / 1650763,73 = 6,058 10-7 m
= 605,8 nm
4-2)
Quelle est l’énergie de la transition électronique correspondante ? (0,25 point)
E = h n = h C / l
E
= 6,62 10-34 * 2,998 108 / 6,058 10-7 = 3,276 10-19 J
4-3)
Combien de neutrons contient le noyau de l’isotope 86Kr. (0,25
point)
A
= Z + N
N
= A – Z = 86 – 36 = 50 neutrons
Exercice
5 : Le Xénon
Il existe quelques composés du Xénon,
parmi eux citons : XeF2 - XeF4 et XeO3
Donner les schémas de Lewis et prévoir les géométries de ces trois composés.
On en donnera une représentation
spatiale. (3 points)
XeF2
Méthode
rapide
:
L'atome central Xe possède 8 électrons
de valence.
L'atome latéral F possède 1 électron
célibataire et forme donc une simple liaison.
Xe forme donc 2 liaisons avec les 2 F
et il lui reste donc 8 - 2 = 6 électrons soit 3 doublets libres.
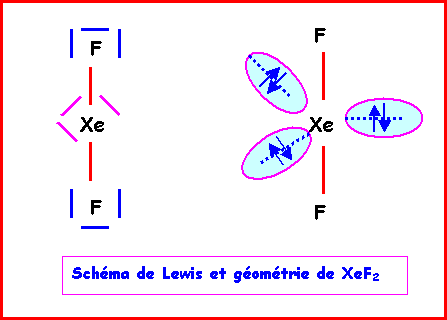
La géométrie est du type AX2E3
autour de l'atome central.
On a donc affaire à une bipyramide à
base triangulaire amputée de 3 sommets.
Comme les répulsions doublet libre
doublet libre sont les plus importantes, les 3 doublets libres se placent en
positions équatoriales et la molécule est linéaire. Les angles FXeF sont de 180°.
XeO3
Méthode
rapide
:
L'atome central Xe possède 8 électrons
de valence.
L'atome latéral O possède 2 électrons
célibataire et forme donc une double liaison.
Xe forme donc 6 liaisons avec les 3 O et il lui reste donc 8 - 6 = 2
électrons soit 1 doublet libre.
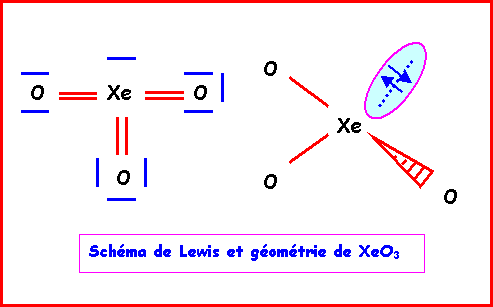
![]()
La géométrie est du type AX3E
autour de l'atome central.
On a donc affaire à un tétraèdre amputé
d'un sommet.
Les angles OXeO sont légèrement inférieurs à 109°, la molécule est en forme de pyramide à
base triangulaire.
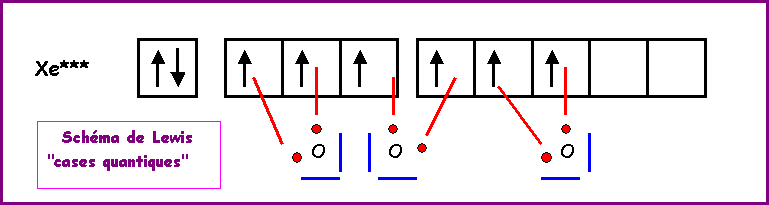
XeF4
Méthode
rapide
:
L'atome central Xe possède 8 électrons
de valence.
L'atome latéral F possède 1 électron
célibataire et forme donc une simple liaison.
Xe forme donc 4 liaisons avec les 4 F
et il lui reste donc 8 - 4 = 4 électrons soit 2 doublets libres.
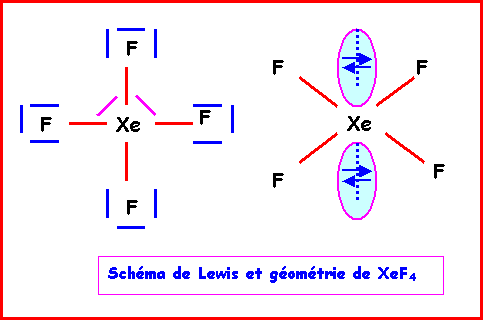
La géométrie est du type AX4E2
autour de l'atome central.
On a donc affaire à un octaèdre amputé
de 2 sommets.
Comme les répulsions doublet libre
doublet libre sont les plus importantes, les 2 doublets libres se placent à l'opposé
l'un de l'autre et la molécule a la forme d'un carré. Les angles FXeF sont tous de 90°, la molécule est
plane.
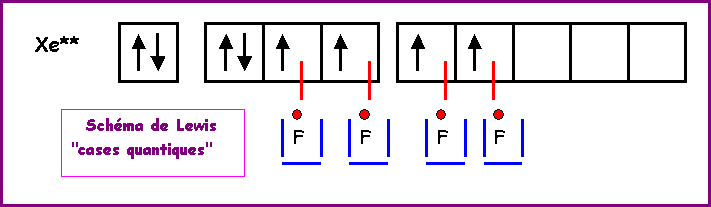
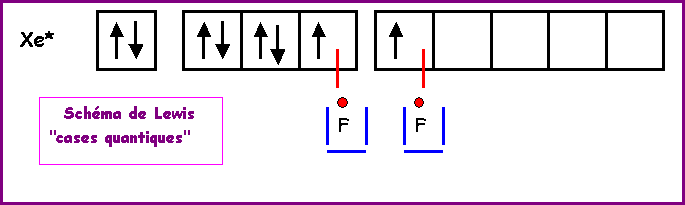
Remarque
: Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc
que très difficilement des composés chimiques stables, et ce n'est qu'en 1962
qu'on réussit à synthétiser de tels composés. C'est la grande réactivité de
l'Oxygène et du Fluor, notamment leurs fortes électronégativités qui expliquent
que XeF2, XeF4 et XeO3 existent.
Les liaisons sont
formées en utilisant les cases 5 d vides du Xénon.
Exercice
6 : Le Radon
Le
radon-222 est un élément radioactif naturel, dont l'importance tient à ce qu'il
est la principale source de radioactivité à laquelle l'homme est exposé.
Cet isotope du radon fait partie de la filiation radioactive
de l'uranium-238 dont il est le sixième descendant. Il est issu de la
désintégration du radium
6-1)
La formation du ![]() Rn s’écrit :
Rn s’écrit : ![]() Ra ®
Ra ® ![]() He +
He +![]() Rn
Rn
Calculer
l’énergie libérée (en MeV) lors de la désintégration d’un noyau de ![]() Ra. (1,5 points)
Ra. (1,5 points)
Dm = m ![]() He + m
He + m ![]() Rn – m
Rn – m ![]() Rn
Rn
|
entités |
masse
en kg |
|
Noyau |
6,644 65 ´ 10 –27 |
|
Noyau 226 Ra |
3,752 438 ´ 10 –25 |
|
Noyau 222 Rn |
3,685 904 ´ 10 –25 |
Dm = 6,644 65 ´ 10 –27 + 3,685 904 ´ 10 –25 – 3,752 438 ´ 10 –25
Dm = 8,75 10-30 kg
E = Dm C2
= 8,75 10-30 * ( 2,998 108 )2 = 7,86 10-13
J = 4,91 MeV
6-2) Il se désintègre lui-même en un isotope du polonium, en
émettant une particule alpha. Ecrire la réaction nucléaire conduisant du Radon
au Polonium. (0,5 point)
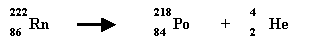
STATISTIQUES :
Voici les résultats après correction des 99 copies rendues
COMMENTAIRE : Résultats désastreux avec
seulement 6 copies au dessus de la moyenne ! Comme habituellement 54% de
copies blanches ou presque ! Pourtant le sujet était facile avec beaucoup
de simples applications du cours et pas de problèmes avec réflexion ou pièges.
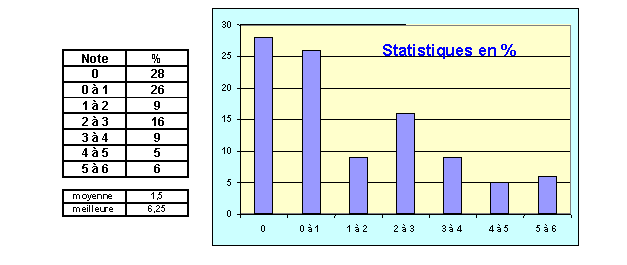
Par exemples :
1 seul étudiant connaît le postulat de Bohr et la formule de
De Broglie !
La très grande majorité de ceux qui ont appliqué la formule
donnée pour le calcul de la force de Coulomb ont oublié qu’il y avait deux
protons dans le noyau mais j’ai quand même compté juste car l’écrasante
majorité n’a même pas fait le calcul !
Le diagramme de He2 a été vu en cours et peu d’étudiants
l’ont traité !
Les molécules XeF2, XeO3 et XeF4
faisaient partie des molécules vues en TD !
lraie = 1 / 1650763,73 : On ne peut rêver d’un pareil cadeau juste une
division à faire et pourtant bien peu l’ont faite….
Bref aucun travail = Aucun résultat !
J’en suis sincèrement désolé mais qu’y faire. Si vous avez
des suggestions faites m’en part….
Thierry
Briere : http://www.chimie-briere.com