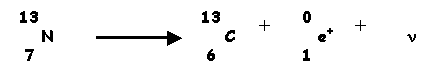
S.M1 - S.V1 - ST1 -STPI 1 SESSION de JUIN 2003
"Initiation à la chimie théorique - atomistique"
CORRIGE
I) Atomes d'azote ( Z = 7 ) et d'oxygène ( Z = 8 ) :
I-1) Etablir la configuration électronique de ces deux éléments. (0,25 point)
N : 1s2 2s2 2p3
O : 1s2 2s2 2p4
I-2) L'azote possède deux isotopes stables 14N et 15N.
I-2-a) Evaluer la masse molaire atomique de l'azote naturel sachant que l'abondance naturelle de l'isotopes 14N est de 99,6%. (1 point)
On fait l'approximation Mi = Ai
On néglige le défaut de masse et la masse des électrons et on suppose de plus que la masse du proton et celle du neutron sont égales à une unité de masse atomique.
M isotope = Z mp + N mn + Z me » Z + N » A
A.N : M = S xi Mi » S xi Ai = 0,996 * 14 + 0,004 * 15 = 14,004 g.mol-1
I-2-b) Il existe également un isotope instable de l'azote 13N, lui attribuer en la justifiant sa forme de radioactivité. Ecrire l'équation de la réaction radioactive correspondante. (0,75 point)
14N : 7 protons et 7 neutrons (stable)
15N : 7 protons et 8 neutrons (stable)
13N : 7 protons et 6 neutrons (instable)
Par rapport aux deux isotopes stables on voit que 13N présente un déficit de neutrons, il cherchera donc à transformer un proton en neutron pour se stabiliser, il devra donc émettre de l'électricité positive et éjectera donc un positron. c'est donc un émetteur de tytpe b+. Au cours de la transformation le nombre de proton du noyau diminue d'une unité mais son nombre de masse reste constant, on obtient donc l'isotope 13C du carbone. Il se forme également un neutrino n.
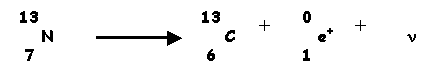
I-2-c) Pour l'atome d'azote évaluer l'énergie de première ionisation par utilisation du modèle de Slater. (2 points)
N : 1 s2 2s2 2p3
EN = 2 E1 + 5 E2
N+ : 1 s2 2s2 2p2
EN+ = 2 E1 + 4 E'2
E.I1(N) = EN+ - EN = 4 E'2 - 5 E2
Z*E2 = 7 - 4*0,35 - 2*0,85 = 3,9
E2 = -13,6 * 3,92 / 4 = -51,71 eV
Z*E'2 = 7 - 3*0,35 - 2*0,85 = 4,25
E'2 = -13,6 * 4,252 / 4 = -61,41 eV
E.I1(N) = EN+ - EN = 4 E'2 - 5 E2 = 4 *- 61,41 + 5 * 51,71 = 12,9 eV
Remarque : La valeur expérimentale est de 14,5 eV, elle est sensiblement plus élevée que la valeur calculée en raison de la grande stabilité de N avec sa sous-couche 2p demi remplie.
II) Molécule NO2
La molécule de Dioxyde d’Azote NO2 possède un électron " célibataire "
Pour établir ces schémas on peut utiliser au choix soit la méthode des cases quantiques, soit la méthode "rapide".
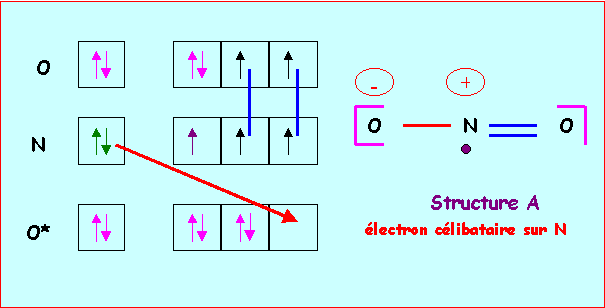
Méthode "rapide" :
Structure A : électron célibataire sur N
Atome central N : 2s2 2p3: 5 électrons
Atome latéral O : 2s2 2p4 : 2 liaisons + 2 doublets libre pour chaque oxygène
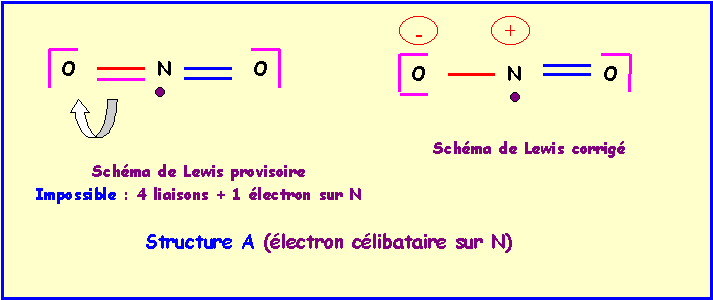
L'atome central fera donc 4 liaisons, il utilise donc 4 électrons et il lui reste bien un électron célibataire. Chaque atome à son nombre normal d'électron (5 pour N et 6 pour O) et il n'y a donc pas de charges formelles. Cela permet d'établir un schéma de Lewis provisoire.

Ce schéma est en fait impossible car N est un élément de la deuxième période qui ne peut faire au maximum que 4 liaisons en utilisant toutes ces cases quantiques et tous ses électrons de valence. Si on veut conserver 1 électron célibataire il ne peut y avoir que trois liaisons au maximum. Il faut donc corriger le schéma de Lewis provisoire en rabattant un doublet de liaison vers un atome d'oxygène. L'azote ne fera alors plus que trois liaisons et possédera bien un électron célibataire, simultanément des charges formelles apparaîtront ; une charge positive sur N et une charge négative sur O.
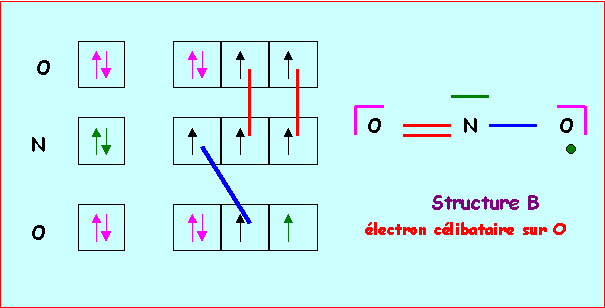
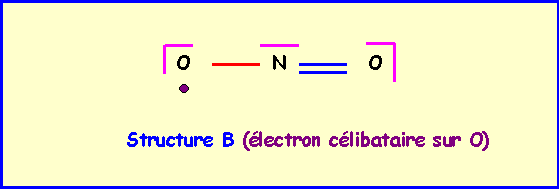
Structure B : électron célibataire sur O
Atome central : N : 2s2 2p3 : 5 électrons
Atome latéral : O : 2s2 2p4 :
2 liaisons + 2 doublets libre pour un oxygène "normal"
On doit distinguer l'atome d'oxygène porteur de l'électron célibataire, cet atome ne fera qu'une liaison et possédera un électron célibataire et 2 doublets libres.
L'atome central fera donc 3 liaisons, il utilise donc 3 électrons et il lui reste donc deux électrons soit un doublet libre. Chaque atome à son nombre normal d'électron (5 pour N et 6 pour O) et il n'y a donc pas de charges formelles. Cela permet d'établir un schéma de Lewis provisoire. Ce schéma est tout a fait satisfaisant et il n'y donc pas lieu de le corriger.
3) Cette molécule peut donner facilement un anion NO2- et un cation NO2+.
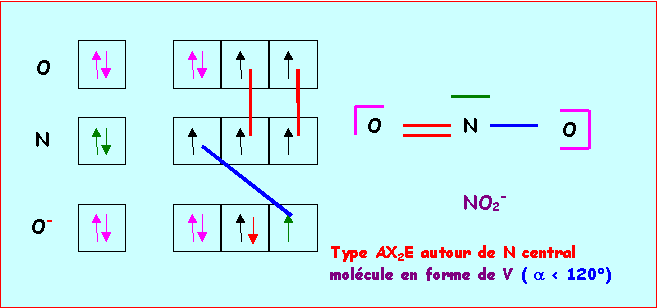
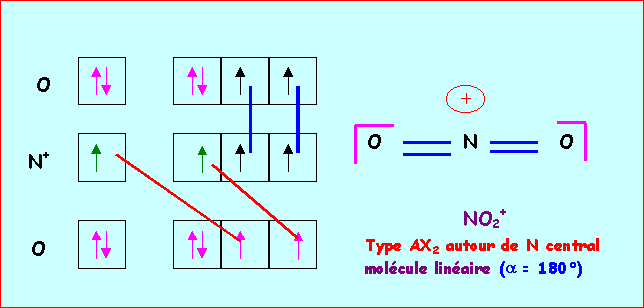
b) Expérimentalement on trouve des angles O - N - O de 180° pour l’un et 115° pour l’autre. Attribuer à chaque ion son angle de liaison.et justifier les écarts éventuels aux valeurs prévues par la théorie V.S.E.P.R.(1 point)
NO2+ : AX2 - molécule linéaire - a = 180°
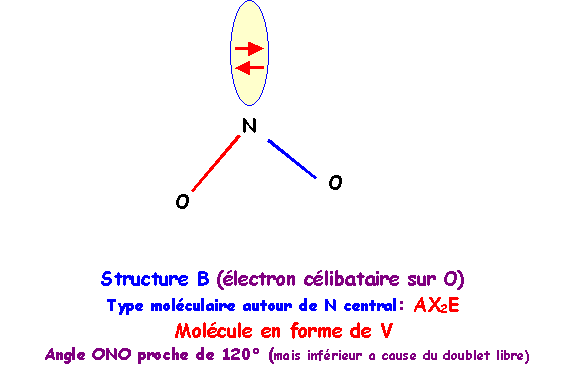
NO2- : AX2E - molécule en forme de V - a » 120°
A cause des répulsions doublet libre/doublet de liaison plus importantes que les répulsions doublet de liaison/doublet de liaison l'angle ONO est en réalité inférieur à 120° et on a a = 115° pour cet ion.
4) Expérimentalement on a pu montrer que l’angle O-N-O était de 134° pour la molécule NO2. Montrer à partir de cette valeur expérimentale de l’angle de liaison que seule la structure de Lewis A de la molécule NO2 peut correspondre à la molécule réelle. (1 point)
Puisque on observe un angle ONO supérieur à 120° une structure de type AX2E est impossible, c'est donc l'atome d'azote qui porte l'électron célibataire (structure A).
Remarque : NO2 est intermédiaire entre NO2+ et NO2- et l'angle ONO a=134° est lui aussi intermédiaire entre la valeur 180° (NO2+) et 115°(NO2-)
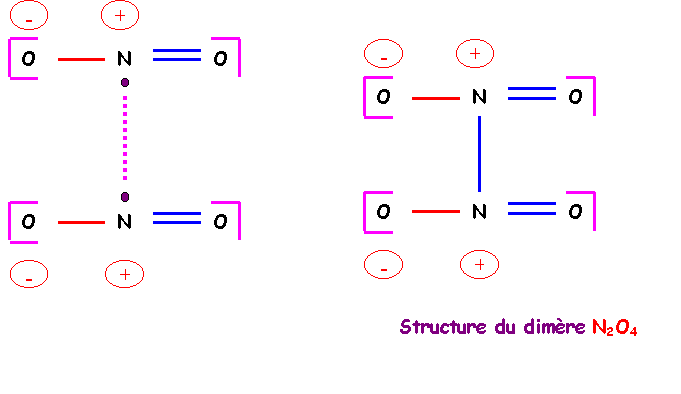
5) La molécule NO2 se dimérise en N2O4 selon la réaction 2 NO2(g) = N2O4(g). Justifier la formation du dimère N2O4 et donner sa structure de Lewis. (1 point)
On peut former une liaison N-N grace aus deux électrons célibataires des deux atomes d'azote, on obtient ainsi le dimère N2O4.