Thierry Briere : http://www.chimie-briere.com/
SESSION
DE MAI 05
ATOMES
ET MOLECULES
Toutes les
réponses devront être justifiées clairement , une réponse non justifiée ne sera
pas prise en compte. La plupart des questions sont indépendantes.
LE BORE - CORRIGE
Données :
Longueur estimée des liaisons :
BN :
Simple : 1,57 A° - Double : 1,46 A° - Triple : 1,22 A°
BO :
Simple : 1,53 A° - Double : 1,32 A° - Triple : 1,19 A°
BH :
Simple 1,21 A°
Effet
d’écran de Slater :
même
groupe 0,35 (0,3 pour 1s) – groupe précédant : 0,85 – groupe
interne : 1
1 D = 0,333 10-29 C.m
e = 1,6 10-19 C
Le
bore possède deux isotopes stables dont le plus abondant est 11B
avec 81,2 % d’abondance naturelle. La masse molaire du bore est 10,811 g.mol-1.
1) Quel est l’autre isotope stable du bore ? (0,5
point)
M = S xi Mi
On fait l'approximation Mi = Ai
M = S xi Ai
Pour 11B : x = 0,812 et A = 11
Pour aB : x = 1 - 0,812 = 0,188 et A = a
M = S xi Ai
10,811 = 0,812 * 11 +
0,188 a
10,811 = 8,932 + 0,188 a
10,811 - 8,932 = 1,879 = 0,188 a
a = 1,879 / 0,188 = 9,995
Il s'agit donc de 10B
2) Donner la configuration électronique de l’atome de Bore (Z =
5). (0,25 point)
Z = 5 : 1s2
2s2 2p1
3)
Calculer sa charge
nucléaire effective Z* dans le modèle de Slater. (0,25
point)
Z* = Z - Ss
1s2 - 2s2 2p1
On "étudie" un des électron du groupe de Slater 2s 2p,
cet électron "voit ":
2 électrons dans le même groupe (2s2p) d'effet d'écran s =
0,35
et deux électrons dans le groupe précédant (1s) d'effet d'écran s = 0,85.
Soit : Z* = 5 - 2*0,35 - 2*0.85 = 2,6
Molécules
BH3 et ion moléculaire BH4- :
4)
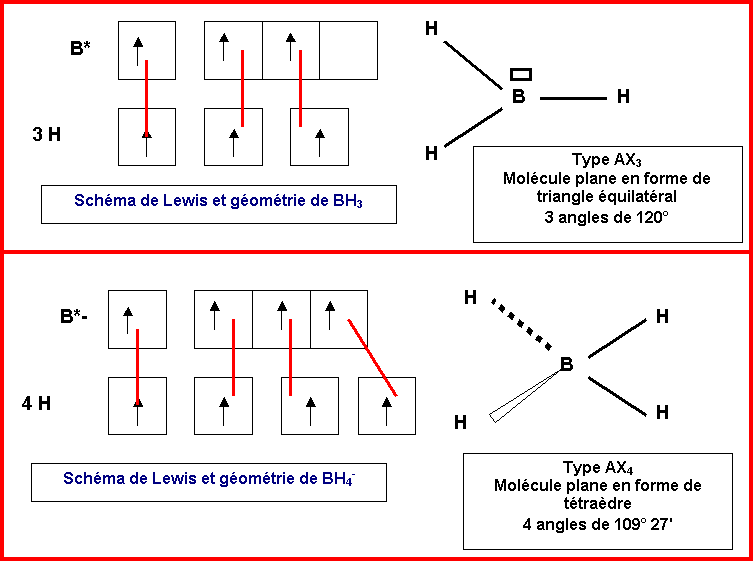
Donner les schémas de Lewis et décrire la géométrie de ces deux espèces
chimiques. On indiquera la valeur prévue par la méthode R.P.E.C.V pour les
angles HBH. (2 points)
B : (1s2) 2s2 2p1

5)
Une des échelles d’électronégativité utilisée par les chimistes calcule celle-ci
par la formule X = 0,34 W + 0,67.
5-1)
Quelle est cette échelle d’électronégativité ? (0,25
point)
Echelle d'Alred et
Rochow
5-2)
Dans cette échelle, à quel phénomène physique est associé la notion
d’électronégativité ? (0,25 point)
Force d'attraction
électrstatique (force de Coulomb) entre le noyau et l'électron périphérique.
On se lace dans le
modèle de Slater, le noyau est supposé posséder la charge Z* et l'électron
ériphérique est supposé situé à la distance Rcov (rayon de covalence de l'atome
considéré). L'électronégativité d'Alred et Rochow est donc supposée
proportionnele à la force de Coulomb.
F = [ 1 / ( 4 p e0 ) ] * Z* e * e / Rcov2
F = K Z* / Rcov2
Pour obtenir des valeurs
du même ordre de grandeur que celle de l'échelle de Pauling on utilise des
coefficients correcteurs.
XAR = a ( Z* / Rcov2 ) + b
5-3)
A quoi correspond le terme W ? (0,25 point)
W = Z*/Rcov2
Dans
cette échelle, les électronégativités du bore et de l’hydrogène sont
respectivement : XB = 2,01 et XH = 2,20.
On
suppose que la formule empirique de Haney-Smith : %IAB = 16 IDXI + 3,5 (DX)2
est une bonne approximation du pourcentage d’ionicité de la liaison AB.
Dans
cette hypothèse calculer :
5-4)
Les charges partielles portées par les atomes B et H dans une liaison BH. (0,5 point)
%IAB
= 16 IDXI + 3,5 (DX)2
DX = 2,20 -2,01 = 0,19
%IAB
= 16 * 0,19 + 3,5 * 0,192 = 3,17 %
d
= 0,0317 * 1,6 10-19 = 5,07 10-21
C
5-5)
Le moment dipolaire d’une liaison BH. (0,5 point)
m = d * d = 5,07 10-21 * 1,21 10-10
= 6,13 10-31 C.m = 0,184 D
5-6)
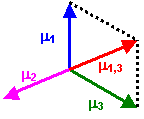
Justifier graphiquement (sans démonstration) que le moment dipolaire global de
BH3 est nul. (0,5 point)
m1,3 = m1 + m3 = - m2 La somme des trois
vecteurs est nulle.
6-1)
On rappelle que selon la règle de Sanderson, un élément est métallique si le
nombre d’électrons sur sa couche de n le plus élevé est inférieur ou égal au
numéro de sa période. D’après ce seul critère, le bore est-il un métal ? (0,25 point)
B : 3 électrons sur la couche de n le plus élevé et appartenant à
la deuxième période, n'est donc pas un métal d'après ce seul critère.
6-2)
D’après sa position dans la classification périodique, quel est l’ion le plus
stable du Bore ? (0,25 point)
Le Bore (1s2) 2s2
2p1 situé dans la
colonne 13 cherche
à perdre ses 3 électrons 2s2 2p1
pour ressembler à l'Hélium 1s2 et
donne donc l'ion B3+.
6-3)
D’après ce seul critère le bore est-il un métal ? (0,25
point)
Les métaux donnent des cations et B semble donc être métallique d'après
ce seul critère.
6-4)
Quel oxyde (considéré comme purement ionique) donne normalement le bore ? (0,25 point)
B donne l'ion B3+
O donne l'ion O2-
L'oxyde de Bore a donc pour formule B2O3
Quand
on dissout cet oxyde dans l’eau, la solution obtenue est acide. L’acide obtenu
est appelé acide borique et a pour formule brute H3BO3.
6-5)
D’après ce seul critère le Bore est-il un métal ? (0,25
point)
Les métaux ont des
oxydes basiques et les non-métaux des oxydes acides.
Le Bore est donc non-métallique selon
ce seul critère.
L’acide
borique est un monoacide faible de pKa = 9,5. Il ne s’agit pas d’un acide de
Bronsted mais d’un acide de Lewis.
7)
Rappelez les définitions de ces deux types d’acides. (0,5
point)
Acide de Bronsted : Substance
capable de libérer des protons H+ (H3O+ dans
l'eau).
Acide de Lewis : Substance
possédant une lacune électronique (case quantique vide) sur sa couche de
valence.
Lors
de sa réaction avec l’eau, l’acide borique fixe un ion OH- et
simultanément un ion H+ est libéré. Cette réaction s’écrit : H3BO3
+ H2O = B(OH)4- + H+
L’expérience
montre que les liaisons BO dans la molécule H3BO3
mesurent 1,36 A° et que les angles OBO ont une valeur expérimentale de 119,7°.
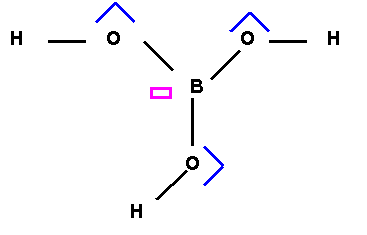
8)
En déduire le schéma de Lewis moléculaire de l’acide borique. ? (0,5 point)
La géométrie moléculaire avec des angles très proches de 120°
suggère un environnement AX3 autour du bore central
La réaction donnée suggère fortement la structure B(OH)3
pour l'acide borique.
On sait que le bore dispose d'une case quantique vide quand il
forme trois liaisons et que cette case vide pourra facilement former une
liaison supplémentaire pour conduire à B(OH)4-. On sait
aussi que B(OH)3 est un acide de Lewis et possède donc une case quantique
vide.
Tous ces indices permettent facilement de déduire le schéma de
Lewis :
9)
Montrer que les valeurs expérimentales sont en accord avec la structure de
l’hybride de résonance si on fait intervenir des formes mésomères que l’on
précisera.
On ne tiendra pas compte des
charges formelles éventuelles dans l’hybride de résonance, on ne s’intéresse
ici qu’aux longueurs des liaisons BO (0,5 point)
La
longueur de liaison BO expérimentale est de 1,36 A°, elle est intermédiaire
entre la simple liaison (1,53 A°) et la double liaison (1,32 A°). Il y a donc
un phénomène de mésomérie grace au doublet libre de l'atome d'oxygène et la
case quantique vide de l'atome de bore qui peuvent facilement former une
liaison supplémentaire.
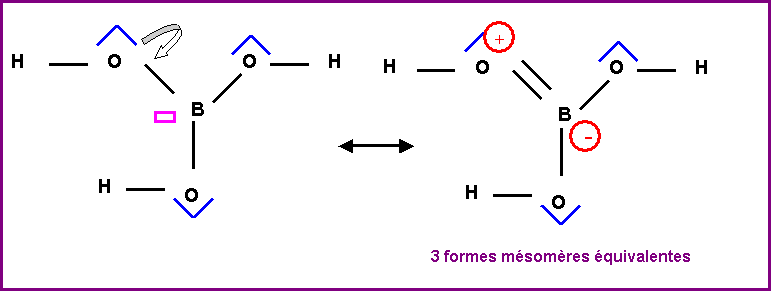
Les formes mésomères obtenues sont
chargées et ne respectent pas les électronégativité de B et O mais elles présentent l'avantage de respecter la
règle de l'Octet. comme B et O sont tous deux des élèments de la deuxième
période cette règle est importante et ces formes mésomères ont un poids non
négligeable, ce qui exlique le raccourcissement de la longueur de liaison
observée expérimentalement.
10)
Molécule BN :
Le bore et l’azote donne un composé de formule BN. La longueur de la liaison BN est de 1,281 A° soit une valeur intermédiaire entre triple et double liaison .
10-1)
Décrire cette molécule dans le modèle de Lewis. (0,25
point)
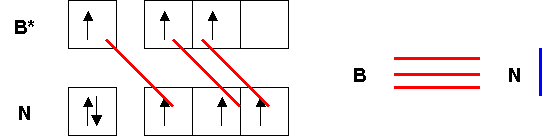
10-2)
Décrire cette molécule dans le modèle C.L.O.A – OM. On supposera qu’il y a des interactions sp. (0,5 point)
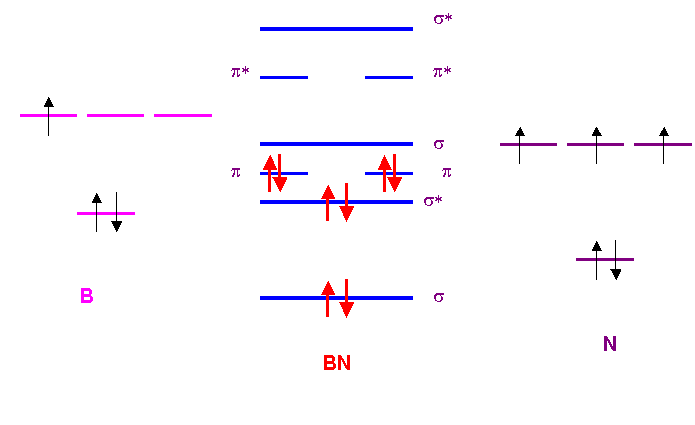
10-3) Montrer que les valeurs expérimentales des longueurs
de liaison BN sont intermédiaires entre les valeurs prévues par ces deux
modèles (0,25 point)
Modèle de Lewis : liaison triple : 1,22 A°
Modèle quantique C.L.O.A-O.M :
Indice de liaison : l = ( 6 - 2 ) / 2 = 2 : double liaison : 1,46
A°
La longueur expérimentale de 1,28 A° est intermédiaire entre celles
prévues par ces deux modèles.
11)
Le cyclotriborazane B3N3H6 : Cette molécule est cyclique et présente une analogie
avec la molécule de benzène C6H6. Il y a alternance des atomes
de bore et d’azote dans un cycle à 6 atomes. Toutes les liaisons BN sont
identiques entre elles, Leur longueur expérimentale est de 1,446 A°. Ecrire les
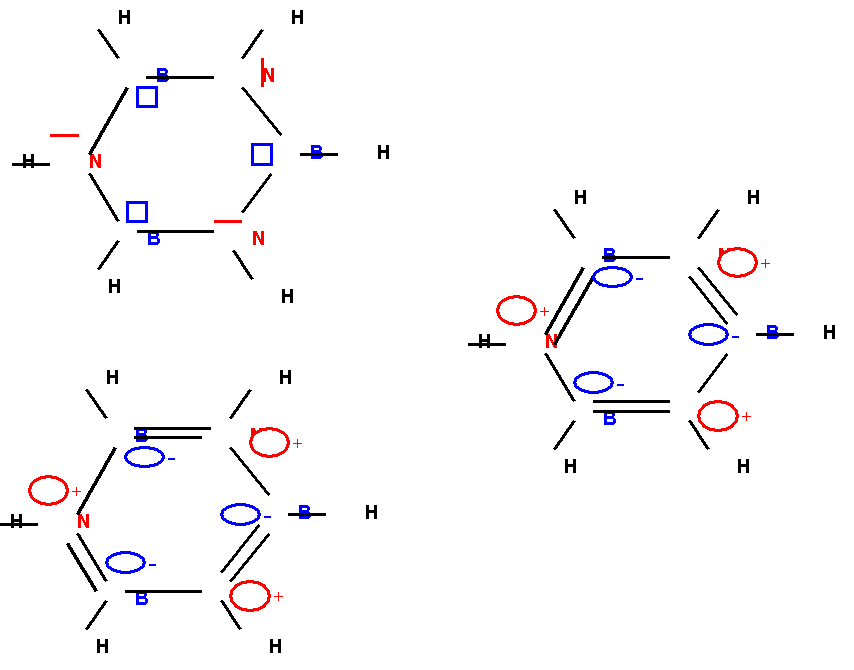
trois formes mésomères principales de la molécule de cyclotriborazane. Montrer
que la longueur de la liaison BN est conforme à l’hybride de résonance. Aide : la
forme mésomère principale est non chargée et ne présente que des liaisons
simples, les deux autres formes mésomères sont chargées avec alternance de
doubles et de simples liaisons BN. (1 point)
Thierry Briere : http://www.chimie-briere.com/