PREMIERE ANNEE DEUG SM-SV-ST-STPI - SESSION DE SEPTEMBRE 2003
"Initiation à la chimie théorique - Atomistique" - CORRIGE
1s |
0,3 |
||||
2s 2p |
0,85 |
0,35 |
|||
3s 3p |
1 |
0,85 |
0,35 |
||
3d |
1 |
1 |
1 |
0,35 |
|
4s 4p |
1 |
1 |
0,85 |
0,85 |
0,35 |
1s |
2s 2p |
3s 3p |
3d |
4s 4p |
On rappelle la formule permettant d'évaluer la longueur d'une liaison A-B
dAB (simple)= 1,11 (RA+RB) - 0,203
Avec RA et RB les rayons de covalence exprimés en A°. Ces rayons de covalence sont eux même estimés par la formule R (A°) = 0,215 n2/Z* + 0,148 n + 0,225
Pour les liaisons multiples on prend liaison Ldouble = 0,86*Lsimple et Ltriple = 0,78 *Lsimple. On admet que ces formules approchées ont une précision de l'ordre de l'ordre de 3% soit à plus ou moins 0,05 A° près.
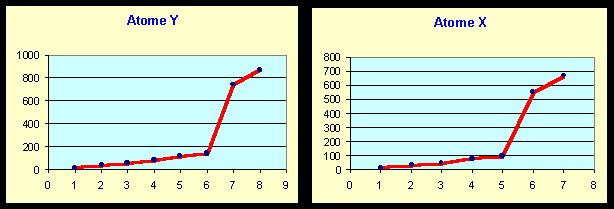
Soient deux atomes X et Y appartenant aux trois premières lignes de la classification périodique.
On donne pour ces deux atomes leurs énergies d'ionisation successives (en eV)
Atome X |
Atome Y |
|
E.I.1 |
14,5 |
13,6 |
E.I.2 |
29,6 |
35,1 |
E.I.3 |
47,4 |
54,9 |
E.I.4 |
77,5 |
77,4 |
E.I.5 |
97,9 |
113,9 |
E.I.6 |
551,9 |
138,1 |
E.I.7 |
666,8 |
739,1 |
E.I.8 |
Non définie |
871,1 |
E.I.9 |
Non définie |
Non définie |
1) A partir de l'évolution des valeurs de leurs énergies d'ionisation successives : Montrer qu'il est possible de déduire leur position dans la classification périodique (colonne et ligne) et donc d'identifier sans aucuns calculs ces deux atomes. On justifiera clairement la réponse.
Atome X : On voit que la sixième ionisation est très difficile, l'ion X5+ possède donc une structure de gaz rare en ns2 np6 , X appartient donc à la colonne 15 de la classification, il peut s'agir de l'azote ou du phosphore. Puisque E.I.8 n'est pas définie il s'agit de l'azote.
Atome Y : On voit que la septième ionisation est très difficile, l'ion Y6+ possède donc une structure de gaz rare en ns2 np6 , Y appartient donc à la colonne 16 de la classification, il peut s'agir de l'oxygène ou du soufre. Puisque E.I.9 n'est pas définie il s'agit de l'oxygène.

2) Par le calcul d'une énergie d'ionisation qu'on choisira vérifier par comparaison avec les valeurs expérimentales que la valeur trouvée est en accord avec votre identification précédente.
Le plus simple et le plus rapide est de calculer l'énergie d'ionisation correspondant à l'ion hydrogénoïde de l'élément considéré car elle est directement donnée par E = -E0 Z2.
Atome X :
Supposons qu'il s'agisse de l'azote : Z = 7 et E.I.7 = -13,6 * 72 = 666,4 eV
La valeur de l'énergie de septième ionisation de X est de 666,8 eV, l'accord est excellent : X = N
Atome Y :
Supposons qu'il s'agisse de l'oxygène : Z = 8 et E.I.8 = -13,6 * 82 = 870,4 eV
La valeur de l'énergie de huitième ionisation de Y est de 871 eV, l'accord est excellent: Y = O
On peut à priori calculer n'importe laquelle des énergies d'ionisation successive, le tableau suivant donne les résultats obtenus avec la technique habituelle.
Atome X : Supposé être l'atome d'azote
N |
N+ |
N2+ |
N3+ |
N4+ |
N5+ |
N6+ |
N7+ |
|
1s |
2 |
2 |
2 |
2 |
2 |
2 |
1 |
0 |
Z*1s |
6,7 |
6,7 |
6,7 |
6,7 |
6,7 |
6,7 |
7 |
|
E 1s |
-610,5 |
-610,5 |
-610,5 |
-610,5 |
-610,5 |
-610,5 |
-666,4 |
0 |
2s 2p |
5 |
4 |
3 |
2 |
1 |
0 |
0 |
0 |
Z* 2s2p |
3,9 |
4,25 |
4,6 |
4,95 |
5,3 |
|||
E 2s2p |
-51,7 |
-61,4 |
-71,9 |
-83,3 |
-95,5 |
0 |
0 |
0 |
E totale |
-1480 |
-1467 |
-1437 |
-1388 |
-1317 |
-1221 |
-666,4 |
0 |
E.I |
E.I.1 |
E.I.2 |
E.I.3 |
E.I.4 |
E.I.5 |
E.I.6 |
E.I.7 |
|
12,92 |
29,818 |
49,215 |
71,111 |
95,506 |
554,608 |
666,4 |
||
EI (X) |
14,5 |
29,6 |
47,4 |
77,5 |
97,9 |
551,9 |
666,8 |
|
Ecart % |
-10,90 |
0,74 |
3,83 |
-8,24 |
-2,45 |
0,49 |
-0,06 |
On voit que le calcul donne de très bons résultats (écarts inférieurs à 4 %) sauf pour E.I.1 (11% d'écart) et E.I.4 (8% d'écart). Ces exceptions s'expliquent par des structures particulièrement stables de l'état de départ, sous couche 2p demi remplie pour N et sous couche 2s remplie pour N3+. Il est donc normal que les valeurs calculées soient dans ces cas (E.I.1 et E.I.4) nettement inférieures aux valeurs expérimentales correspondantes.
Atome Y : Supposé être l'atome d'oxygène
O |
O+ |
O2+ |
O3+ |
O4+ |
O5+ |
O6+ |
O7+ |
O8+ |
|
1s |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
1 |
0 |
Z*1s |
7,7 |
7,7 |
7,7 |
7,7 |
7,7 |
7,7 |
7,7 |
8 |
|
E1s |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-806,3 |
-870,4 |
0 |
2s 2p |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
||
Z* 2s2p |
4,55 |
4,9 |
5,25 |
5,6 |
5,95 |
6,3 |
|||
E2s2p |
-70,4 |
-81,6 |
-93,7 |
-106,6 |
-120,4 |
-134,9 |
0 |
0 |
0 |
E totale |
-2035 |
-2021 |
-1987,5 |
-1933 |
-1853 |
-1748 |
-1613 |
-870,4 |
0 |
EI |
E.I.1 |
E.I.2 |
E.I.3 |
E.I.4 |
E.I.5 |
E.I.6 |
E.I.7 |
E.I.8 |
|
14,2 |
33,3 |
55,0 |
79,1 |
105,8 |
134,9 |
742,3 |
870,4 |
||
EI (Y) |
13,6 |
35,1 |
54,9 |
77,4 |
113,9 |
138,1 |
739,1 |
871,1 |
|
Ecart % |
4,12 |
-5,07 |
0,14 |
2,24 |
-7,12 |
-2,28 |
0,43 |
-0,08 |
On voit que le calcul donne de très bons résultats (écarts inférieurs à 3 %) sauf pour E.I.1 (4% d'écart), E.I.2 (5% d'écart) et E.I.5 (7% d'écart).
Ces exceptions s'expliquent :
3) Ces deux atomes donnent des molécules X2 et Y2. L'expérience montre que :
Montrer que ces faits expérimentaux sont bien en accord avec votre identification des atomes X et Y.
Pour cela on établira le diagramme qualitatif des orbitales moléculaires de X2 et Y2. On en déduira la forme de magnétisme correspondante. On déterminera ensuite l'indice de liaison pour chaque molécule. On calculera enfin la longueur de la liaison (à 0,03 A° près) avec les formules rappelées en début d'énoncé et on vérifiera l'accord avec les valeurs expérimentales.
Molécule X2 = N2
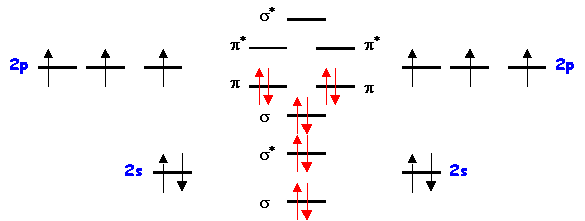
Pas d'électrons célibataires : molécule diamagnétique
Indice de liaison : nl = 1/2 ( 8 - 2 ) = 3
Longueur de liaison :
RN = 0,215 * 4 / 3,9 + 0.148 * 2 + 0,225 = 0,742 A°
LN-N = 1,11 * ( 0,742 + 0,742 ) - 0,203 = 1,444 A°
Soit : 0,78 * 1,444 = 1,13 ± 0,05 A°
1,08 A°< l < 1,18 A°
La valeur expérimentale de 1,094 A° est en bon accord avec la valeur estimée par la formule empirique.
Remarque : Qu'il y ait ou non intéractions sp ne modifie en rien les conclusions.
Molécule Y2 = O2
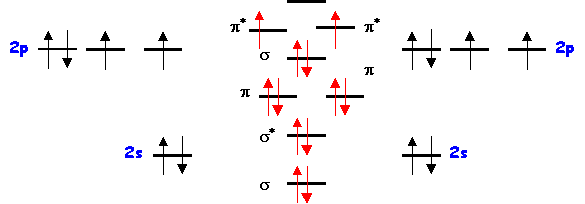
Présence de deux électrons célibataires : molécule paramagnétique
Indice de liaison : nl = 1/2 ( 8 - 4 ) = 2
Longueur de liaison :
RO = 0,215 * 4 / 4,55 + 0,148 * 2 + 0,225 = 0,710 A°
LO-O = 1,11 * ( 0,710 + 0,710 ) - 0,203 = 1,373 A°
Soit : 0,86 * 1,373 = 1,18 ± 0,05 A°
1,13 A°< l < 1,23 A°
La valeur expérimentale de 1,207 A° est en bon accord avec la valeur estimée par la formule empirique.
Remarque : Qu'il y ait ou non intéractions sp ne modifie en rien les conclusions.
4) Il existe aussi des molécules de formule X3 et Y3.
Montrer que ces résultats expérimentaux sont en accord avec votre identification des atomes X et Y et qu'ils peuvent s'expliquer par l'intervention de formes mésomères qu'on précisera.
Molécule X3 = N3
Méthode rapide :
N : 2s2 2p3
N central : 5 électrons
N latéral : 1 doublet libre et trois liaisons
L'azote central devrait donc faire 6 liaisons, comme il ne possède que 5 électrons il ne peut en faire que 5, un des atomes latéraux devra donc garder un électron célibataire et ne faire que 2 liaisons. De plus l'azote faisant partie de la deuxième ligne ne peut faire au maximum que quatre liaisons on devra donc corriger le schéma en rabattant un doublet de liaison vers un azote latéral. Il y a deux manières de procéder qui conduiront a deux formes mésomères différentes.
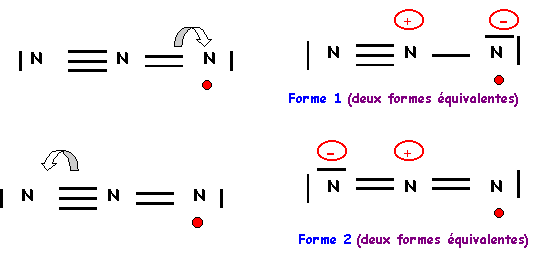
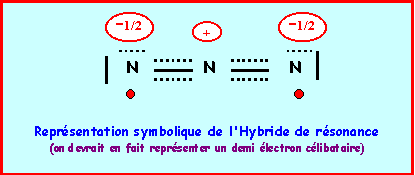
On a finalement quatre formes mésomères de "poids statistiques" équivalents, les liaisons NN seront identiques entre elles.
Nous avons calculé précédemment la longueur des liaisons NN (à 0,05 A° près) :
Simple : 1,44 A° - Double : 1,24 A° - Triple : 1,13 A°
La longueur de liaison réelle de 1,181 A° est intermédiaire entre celle de la double et de la triple liaison ce qui correspond bien à l'hybride de résonance. La géométrie autour de l'azote central est du type AX2 dans toutes les formes mésomères, la molécule est bien linéaire et paramagnétique.
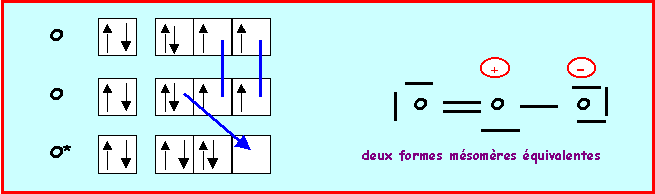
On aurait pu aussi établir les schémas de Lewis par la méthode des cases quantiques :
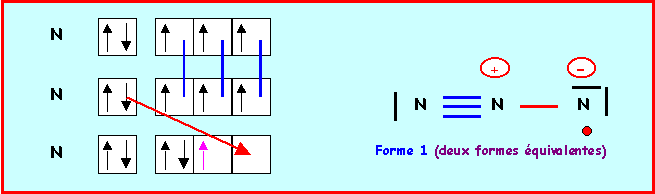
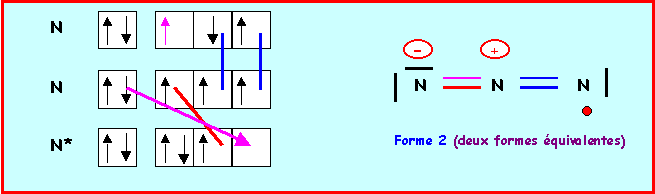
Molécule Y3 = O3
Méthode rapide :
N : 2s2 2p4
O central : 6 électrons
O latéral : 2 doublets libres et deux liaisons
L'oxygène central devrait donc faire 4 liaisons, comme il possède 6 électrons il lui restera un doublet libre. L'oxygène faisant partie de la deuxième ligne ne peut faire au maximum que quatre liaisons en utilisant toutes ses cases quantiques de valence, s'il garde un doublet libre, il ne peut faire que trois liaisons. On devra donc corriger le schéma en rabattant un doublet de liaison vers un oxygène latéral.
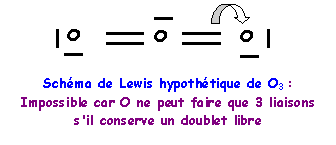
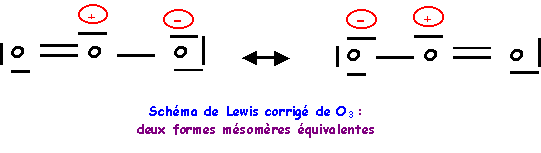
On à finalement deux formes mésomères de "poids statistiques" équivalents, les liaisons OO seront identiques entre elles.
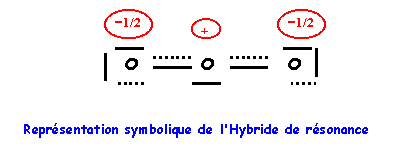
Nous avons calculé précédemment la longueur des liaisons OO (à 0,05 A° près) :
Simple : 1,37 A° - Double : 1,18 A° - Triple : 1,07 A°
La longueur de liaison réelle de 1,278 A° est intermédiaire entre celle de la simple et de la double liaison ce qui correspond bien à l'hybride de résonance. La géométrie autour de l'oxygène central est du type AX2E, la molécule est bien coudée en forme de V avec un angle proche de 120° (116,8° à cause du doublet libre).
On aurait pu aussi établir le schéma de Lewis par la méthode des cases quantiques :