SUJET DE CHIMIE THEORIQUE – ATOMISTIQUE : FEVRIER 2000
CORRIGE
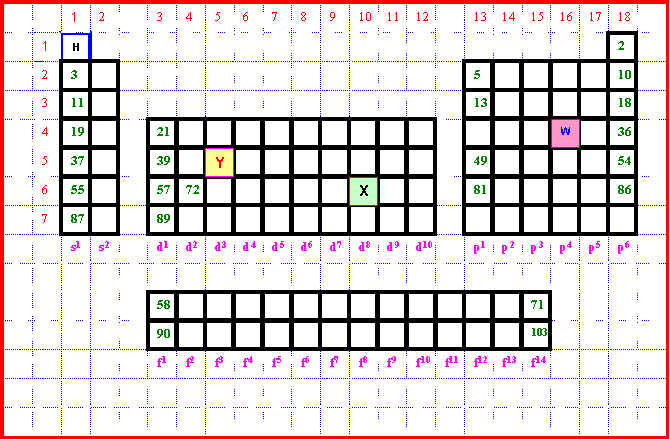
1) Dessiner, dans le quadrillage ci dessous, les contours de la classification périodique des éléments. L’élément Hydrogène est déjà placé pour donner l’échelle (1 case du quadrillage = 1 case de la classification). On a aussi indiqué les positions de la période 1 et de la colonne 1. Attention, le quadrillage fournit est plus grand que nécessaire.

2) Un élément X a pour numéro atomique Z = 78
Donner sa configuration électronique et le placer dans la classification périodique.
Elément X : Z = 78 :
Z = 78 = 54 + 24
(Xe) 6s2 4f14 5d8
(Xe) 4f14 ; 5d8 ; 6s2
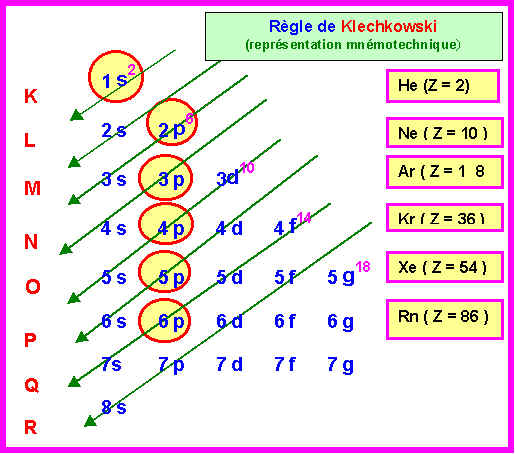
Remarque : L'élément X est le Platine Pt. Le Platine est une exception à la règle de Klechkowski et sa configuration réelle est différente de celle trouvée par simple application de la règle.
(Xe) 4f14 ; 5d9 ; 6s1
Cette exception n'étant pas "à connaître par cœur", la réponse trouvée précédemment sera tout de même considérée comme correcte. Un petit bonus hors barème sera accordé aux étudiants qui auront signalé le problème.
Le "positionnement" dans la classification peut se faire soit à partir de la configuration soit a partir du numéro atomique. Voir classification plus haut.
3) Un élément Y à pour configuration électronique (Kr) 4d3 5s2. Placer cet élément dans la classification.
Le "positionnement" dans la classification peut se faire soit à partir de la configuration soit a partir du numéro atomique (ici Z = 36 + 5 = 41). Voir classification plus haut.
4) Le Cérium Ce a pour configuration électronique simplifiée K2 L8 M18 N19 O9 P2
a) Donner sa configuration complète déduite de cette configuration simplifiée.
K2 = 1s2
L8 = 2s2 2p6
M18 = 3s2 3p6 3d10
N19 = 4s2 4p6 4d10 4f1
O9 = 5s2 5p6 5d1
P2 = 6s2
1s2, 2s2 2p6, 3s2 3p6 3d10 , 4s2 4p6 4d10 4f1 , 5s2 5p6 5d1, 6s2
b) Quel est son numéro atomique ?
Z = 2 + 8 + 18 + 19 + 9 + 2 = 58
c) Déterminer la configuration électronique qu’on trouverait simplement à partir de la règle de Klechkowski. Conclusion ?
Z = 58 = 54 + 4
(Xe) 6s2 4f 2
soit (Xe) 4f 2 6s2
(1s2, 2s2 2p6, 3s2 3p6 3d10 , 4s2 4p6 4d10 , 5s2, 5p6), 4f2 , 6s2
Les deux configurations trouvées ne coïncident pas, il s'agit donc d'une exception à la règle de Klechkowski.
Réalité : 1s2, 2s2 2p6, 3s2 3p6 3d10 , 4s2 4p6 4d10 4f1 , 5s2 5p6 5d1, 6s2
Klechkowski : 1s2, 2s2 2p6, 3s2 3p6 3d10 , 4s2 4p6 4d10 , 5s2, 5p6, 4f2 , 6s2
Un électron du niveau 4f semble avoir sauté sur le niveau 5d.
Cela est caractéristique des éléments du bloc f (lanthanides et actinides).
5) Un élément W appartient à la quatrième période et possède deux et seulement deux électrons " célibataires " (seuls dans une case quantique).
Combien de possibilités y a-t-il ? Préciser pour chacune le N° de la colonne et celui de la ligne.
Les diverses possibilités sont les suivantes :
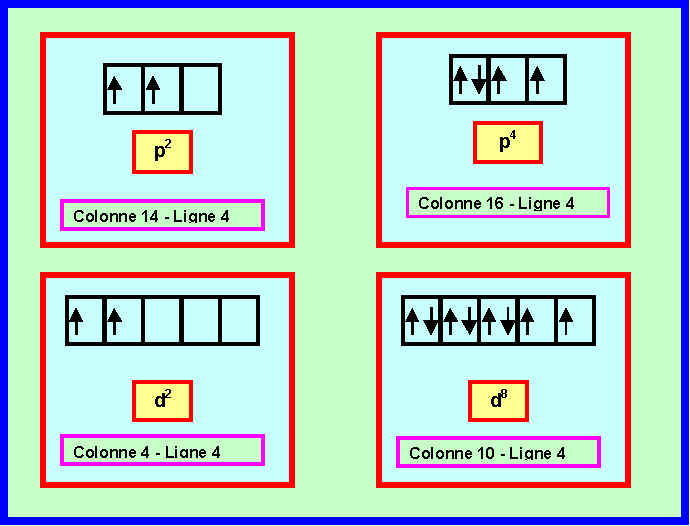
On sait de plus que cet élément n’est pas un élément de transition. Combien reste-t-il de possibilités ? Préciser pour chacune le N° de la colonne et celui de la ligne.
On élimine donc les configurations de type d (d2 et d8) , il ne reste donc plus que les configuration de type p (soit p2 et p4)
p2 : Colonne 14 - Ligne 4
p4 : Colonne 16 - Ligne 4
On sait de plus que cet élément appartient a la famille des chalcogènes. Combien reste-t-il de possibilités ? Préciser pour chacune le N° de la colonne et celui de la ligne.
Les chalcogènes sont les éléments appartenant au groupe de l'Oxygène de la colonne 16. La seule possibilité restante est donc la configuration p4.
Il s'agit finalement de l'élément Arsenic :
W = As : Colonne 16 - Ligne 4
6) En utilisant les approximations hydrogénoïdes de Slater, évaluer l’énergie de troisième ionisation de l’atome de Béryllium (Be – Z = 4)
Be : 1s2 2s2 - Be+ : 1s2 2s1 - Be2+ : 1s2 - Be3+ : 1s1
Troisième ionisation : Be2+ = Be3+ + e-
E.I3 = EBe3+ - EBe2+
EBe2+ = 2 E1
EBe3+ = E'1
E.I3 = E'1 - 2 E1
E = -13,6 * Z*2/n2
Z*Be2+ = 4 - 0,3 = 3,7
Z*Be3+ = 4
E1 = -13,6 * 3,72 = -186,18 eV
E'1 = -13,6 * 42 = -217,6 eV
E.I3 = E'1 - 2 E1 = 154,8 eV
Remarque : La valeur expérimentale trouvée dans les tables est de 153,9 eV. Il y a donc un bon accord entre valeur calculée et valeur expérimentale (0,7 % d'écart relatif).