S.M 1 - Session de Juin 2001 - Deuxième période
" Initiation à la Chimie Théorique - Les Molécules "
CORRIGE
Le monoxyde de diazote (ou oxyde nitreux) de formule N2O est un gaz incolore et peu réactif. Il est plus connu sous le nom de gaz hilarant à cause de ses propriétés euphorisantes. Il était autrefois utilisé comme anesthésique général. Actuellement, il est utilisé comme agent propulseur d'aérosol en particulier pour les crèmes fouettées en bombes (Chantilly).
Ce gaz est donc très sympathique et va servir de base à cet exercice très amusant !
Données :
Formule approximative de calcul des longueurs de liaisons :
Simple liaison : L (A°) = 0,239 S ( n*2/Z*) + 0,164 S n* + 0,297
Double liaison : 86 % de la simple - Triple liaison : 78% de la simple
La formule empirique ne donnant qu'une précision de 2% sur la longueur des liaisons et la longueur des liaisons covalentes étant de l'ordre de grandeur de 1 à 2 A° on prend la valeur moyenne de 1,5 A° et on admettra que l'incertitude sur une longueur de liaison est donc de 2 *1,5 / 100 = ± 0,03 A°.
Constantes d'écran de Slater :
1s |
0,3 |
|||
2s 2p |
0,85 |
0,35 |
||
3s 3p |
0,85 |
0,85 |
0,35 |
|
3d |
1 |
1 |
1 |
0,35 |
1s |
2s 2p |
3s 3p |
3d |
Molécule N2O : Azote central
Energie d'ionisation : 12,9 eV
| Liaison | N - N |
N - O |
| Longueur (A°) | 1,128 |
1,184 |
| Energie de dissociation (eV) | 4,9 |
1,7 |
Ion moléculaire N2O+ : Azote central
| Liaison | N - N |
N - O |
| Longueur (A°) | 1,155 |
1,185 |
A) Molécule N2O :
1) En utilisant la formule empirique, évaluer les longueurs des liaisons N-O (simple, double et triple) et N-N (simple, double et triple).
N : 1 s2 2s2 2p3
Z* = 7 - ( 4 * 0,35 ) - ( 2 * 0,85 ) = 3,9 et n* = 2
n*2 / Z* = 4 / 3,9 = 1,026
O : 1 s2 2s2 2p4
Z* = 8 - ( 5 * 0,35 ) - ( 2 * 0,85 ) = 4,55 et n* = 2
n*2 / Z* = 4 / 4,55 = 0,879
Simple liaison: L (A°) = 0,239 S ( n*2/Z*) + 0,164 S n* + 0,297
Double liaison : 86 % de la simple - Triple liaison : 78% de la simple
Incertitude sur la longueur de liaison : ± 0,03 A°
Liaison N - N :
L (A°) = 0,239 * ( 2 * 1,026 ) + 0,164 * ( 2 + 2 ) + 0,297 = 1,44 ± 0,03 A°
Double liaison N-N : L = 0,86 * 1,443 = 1,24 ± 0,03 A°
Triple liaison N-N : L = 0,78 * 1,443 = 1,13 ± 0,03 A°
Liaison N - O :
L (A°) = 0,239 * ( 0,879 + 1,026 ) + 0,164 * ( 2 + 2 ) + 0,297 = 1,41 ± 0,03 A°
Double liaison N-O : L = 0,86 * 1,41 = 1,21 ± 0,03 A°
Triple liaison N-O : L = 0,78 * 1,41 = 1,10 ± 0,03 A°
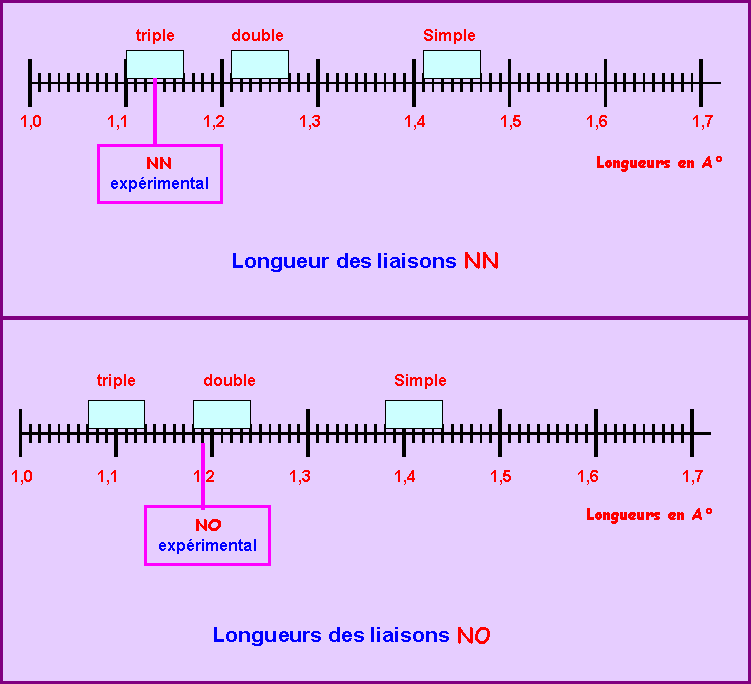
Résumé :
Liaison |
simple |
double |
triple |
N-N |
1,41 < L < 1,47 |
1,21 < L < 1,27 |
1,10 < L < 1,16 |
N-O |
1,38 < L < 1,44 |
1,18 < L < 1,24 |
1,07 < L < 1,13 |
2) En tenant compte de l'incertitude moyenne de ± 0,03 A° sur les longueurs calculées, placer les "domaines" de chaque types de liaison sur les schémas suivants:

3) En se basant uniquement sur leurs longueurs expérimentales, conclure sur la nature apparente des liaisons NN et NO dans la molécule N2O.
D'après les longueurs de liaisons observées, il semblerait que la liaison N-N est triple et que la liaison N-O est double.
4) Donner le schéma de Lewis de N2O qu'on peut déduire des questions précédantes et expliquer pourquoi ce schéma est en fait impossible.
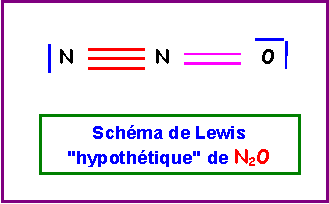
Dans ce schéma de Lewis hypothétique, l'atome d'Azote ferait 5 liaisons; cela est impossible car l'Azote appartient à la deuxième ligne de la classification périodique et ne possède donc que 4 cases quantiques sur sa couche de valence. Il ne peut donc faire au maximum que 4 liaisons.
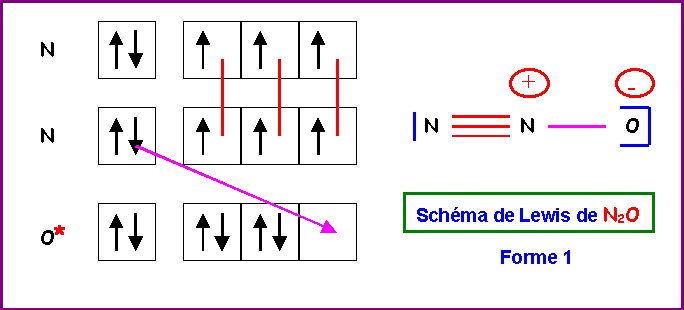
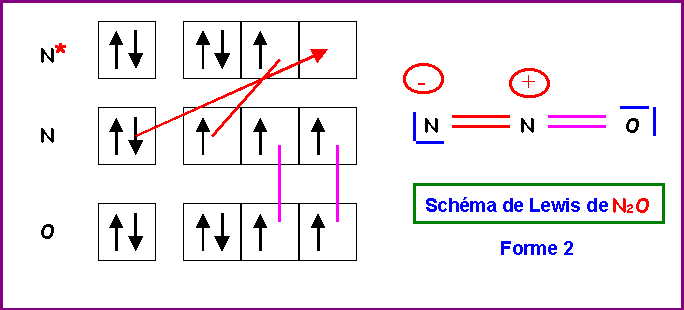
5) Montrer qu'en réalité, on peut écrire deux formes mésomères différentes pour cette molécule. Indiquer par des flèches courbées les déplacements électroniques qui permettent de passer de l'une à l'autre.
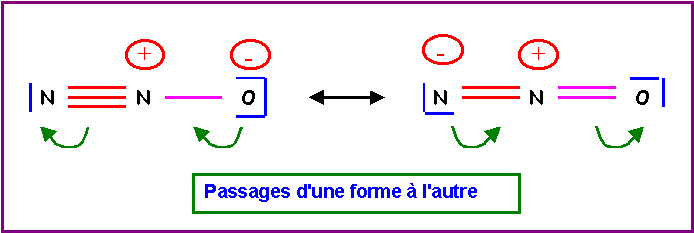
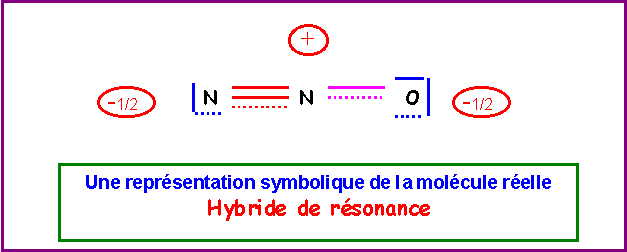
6) Donner une représentation symbolique de l'hybride de résonance.
On supposera pour simplifier qu'en raison des électronégativités relativement proches de O et N les deux formes mésomères ont un poids statistique identique.
B) Etude des liaisons N-N et N-O :
1) En utilisant l'approximation C.L.O.A - O.M décrire la liaison qui s'établit entre deux atomes d'Azote. Etablir le diagramme énergétique des O.M et calculer l'indice de liaison.
On supposera qu'il y a interaction sp.
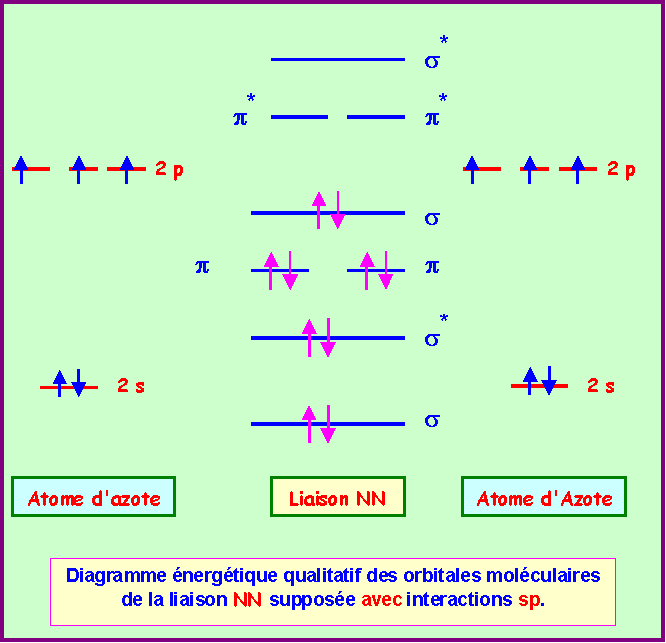
Calcul de l'indice de liaison :
nl = 1/2 ( n - n* ) = 1/2 ( 8 - 2 ) = 3
2) En utilisant l'approximation C.L.O.A - O.M décrire la liaison qui s'établit entre un atome d'Azote et un atome d'Oxygène. Etablir le diagramme énergétique des O.M et calculer l'indice de liaison.
On supposera qu'il y a interaction sp.
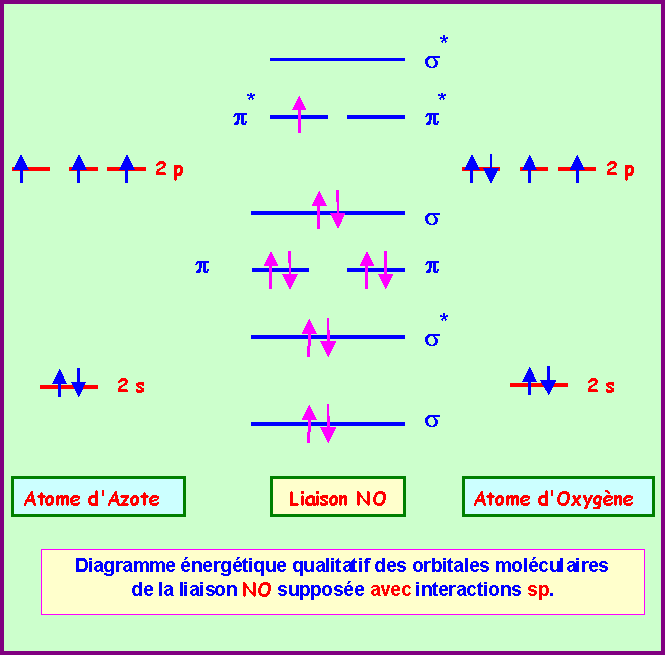
Calcul de l'indice de liaison :
nl = 1/2 ( n - n* ) = 1/2 ( 8 - 3 ) = 2,5
3) Dans N2O, l'énergie de dissociation de la liaison N-O (1,7 eV) est nettement inférieure à celle de la liaison N-N (4,9 eV). Justifier simplement.
La dissociation correspond à la rupture de la liaison.
L'indice de liaison est en première approximation une bonne mesure de l'énergie de dissociation, plus l'indice de liaison est élevé et plus la liaison est solide et donc difficile a casser.
Plus l'indice de liaison est élevé et plus l'énergie de dissociation augmente.
La liaison NN présentant un indice de liaison plus élevé que celui de la liaison NO il est normal que son énergie de dissociation soit plus élevé.
Remarque : En toute rigueur l'énergie de liaison dépend aussi de la nature des atomes liés on ne peut comparer directement deux liaisons très différentes entre elles. Dans le cas qui nous intéresse ici, on peut considérer que N et O sont suffisamment proches pour que l'on puisse sans grands risques comparer les liaisons NO et NN entre elles.
C) Ionisation de N2O
En enlevant un électron à la molécule N2O on obtient l'ion moléculaire N2O+.
Si on compare les longueurs des liaisons dans N2O et N2O+, on constate que la longueur de la liaison NN augmente sensiblement alors que celle de la liaison NO reste pratiquement constante.
1) A quelle liaison appartient l'électron arraché ?
Puisque seule la liaison NN est modifiée c'est que l'électron arraché appartient à cette liaison.
2) Justifier ce résultat en utilisant les résultats des questions B -1 et B -2.
Pour cela on supposera qu'on arrache un électron à une liaison N-N ou à une liaison N-O et on jugera de l'effet de cette action sur la longueur de la liaison correspondante.
Liaison NN :
Le dernier niveau occupé est un niveau liant. Si on arrache un électron, on déstabilise la molécule et l'indice de liaison diminue. La longueur de la liaison augmente donc.
Liaison NO :
Le dernier niveau occupé est un niveau anti-liant. Si on arrache un électron, on stabilise la molécule et l'indice de liaison augmente. La longueur de la liaison diminue donc.
L'augmentation observée de la longueur de liaison NN confirme bien le fait que l'électron arraché appartient à cette liaison. (Si l'électron arraché appartenait à la liaison NO on observerait une diminution de la longueur de celle-ci. )
3) A partir des résultats précédants justifier le fait que l'énergie d'ionisation de N2O est particulièrement élevée (12,9 eV).
Puisque l'électron arraché est un électron liant de la liaison NN il est normal que l'énergie d'ionisation soit élevée. En effet l'ionisation déstabilise la molécule et sera donc difficile. (Si l'électron arraché appartenait à la liaison NO, il aurait s'agit d'un électron anti-liant, le processus aurait stabilisé la molécule, il aurait été facile et on observerait donc une énergie d'ionisation faible.)