S.M 1 - DEUXIEME PERIODE : SESSION DE JUIN 2002
SUJET DE CHIMIE THEORIQUE – ATOMISTIQUE
CORRIGE
Longueurs approximatives de quelques liaisons
Longueur de Liaison en A° |
O - H |
N - N |
N - O |
|
simple |
0,99 < l < 1,03 |
1,41 < l < 1,47 |
1,38 < l < 1,44 |
|
double |
1,38 < l < 1,44 |
1,19 < l < 1,24 |
||
triple |
1,10 < l < 1,15 |
1,08 < l < 1,12 |
||
Exercice 1 : Géométrie de l'acide nitrique HNO3
1) Longueurs des liaisons
La détermination expérimentale des longueurs de liaisons à donné les résultats suivants : 0,96 A° - 1,21 A° - 1,21 A° - 1,41 A°
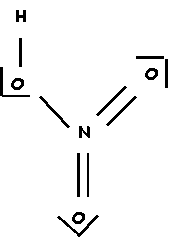
1-a ) D'après les valeurs expérimentales que peut-on déduire sur la multiplicité (simple/double/triple) apparente des liaisons N - O de la molécule HNO3 ? Donner le schéma de Lewis hypothétique correspondant.
1,19 < 1,21 A° < 1,24 è 2 doubles liaisons
1,38 < 1,41 A° < 1,44 è 1 simple liaison

1-b ) Pourquoi un tel schéma de Lewis est-il en fait impossible ?
L'azote est un élément de la deuxième période et ne possède que 4 cases quantiques ( 2s et 2p) sur sa couche de valence il ne pourra donc faire que 4 liaisons au maximum et non 5 comme dans ce schémés hypothétique.
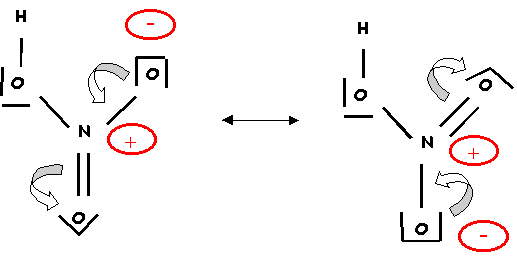
1-c) Corriger le schéma de Lewis précédent. Montrer que plusieurs formes mésomères sont possibles et schématiser le passage d'une forme à l'autre.
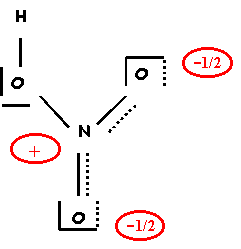
1-d) Donner une représentation symbolique de l'hybride de résonance.
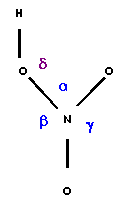
1-e) Attribuez les longueurs de liaisons expérimentales.
Liaison |
l1 (OH) |
l2 (NO) |
l3 (NO) |
l4 (NO) |
| Longueur (A°) | 0,96 |
1,21 |
1,41 |
1,21 |
2) Angles entre liaisons
2-1) Dans le modèle de Gillespie (V.S.E.P.R ou R.P.E.C.V) de quel type AXnEm est l'environnement de l'atome d'azote dans la molécule HNO3.
AX3
2-2) Quelles valeurs prévoit-on pour les angles ONO dans ce modèle ?
a = 120 ° - b = 120 ° - g = 120 °
2-3) Quelle est l'état d'hybridation de l'atome d'azote qui permet de décrire simplement cette géométrie ?
Hybridation : sp2
2-4) Dans le modèle de Gillespie (V.S.E.P.R ou R.P.E.C.V) de quel type AXnEm est l'environnement de l'atome d'oxygène lié à l'atome d'hydrogène.
AX2E2
2-5) Quelle valeur prévoit-on pour l'angle NOH dans ce modèle ? Quelle est l'état d'hybridation de l'atome d'oxygène qui permet de décrire simplement cette géométrie ? d = 109,5 ° - Hybridation : sp3
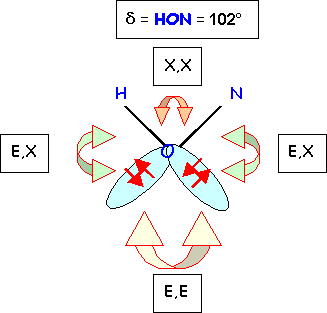
La détermination expérimentale des angles de liaisons a donné les résultats suivants en phase gazeuse : 102° - 114° - 116° - 130°
2-6) Quel est l'angle qui vaut 102° ? Comparer avec sa valeur prévue par la méthode R.P.E.C.V. Justifier l'écart éventuel.
Les répulsions doublets libres / doublets libres (E,E) et les répulsions doublets libres / doublets de liaison (E,X) sont plus fortes que les répulsions doublets de liaison / doublets de liaison (X,X) car les doublets libres sont plus proches de l'atome central que les doublets de liaisons. L'angle HON est donc sensiblement plus petit que sa valeur "théorique" de 109,5°
2-7) Les trois angles ONO ne sont pas identiques, l'un est nettement supérieur aux deux autres.
a) Quel est l'angle qui vaut 130° ?
g = 130 °
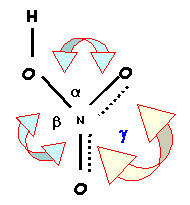
b) Pourquoi cet angle est-il plus grand que les deux autres ?
Les répulsions double liaison / double liaison sont plus importante que les
répulsions double liaison / simple liaison. L'angle g est donc sensiblement augmenté par rapport à sa valeur "théorique" de 120°.
c) Les deux autres angles sont très proches l'un de l'autre avec une différence de 2° seulement. Essayer de justifier cette petite différence.
Il existe une dissymétrie a cause de la liaison OH l'angle "proche" de cette liaison OH sera un peu plus important que l'angle "éloigné" de cette liaison.
Exercice 2 : Le Diazote N2
1) Décrire la molécule de diazote N2 dans le modèle C.L.O.A - OM.
2) Calculer l'indice de liaison.
3) Classer N2 , N2- et N2+ par ordre de stabilité croissante. Justifiez.
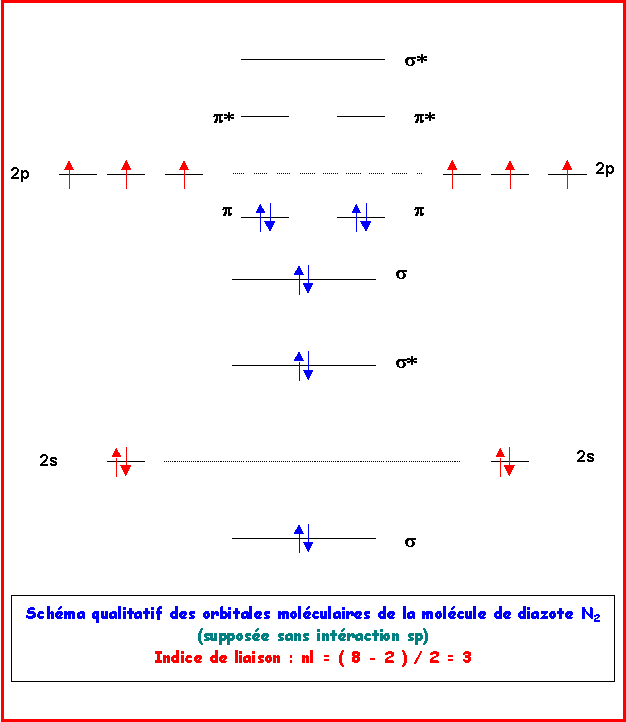
N2 : 8 électrons liants et 2 électrons anti-liants è nl = 1/2 ( 8 - 2 ) = 3
Cette molécule est très stable.
N2+ : 7 électrons liants et 2 électrons anti-liants è nl = 1/2 ( 7 - 2 ) = 2,5
L'enlévement d'un électron liant déstabilise la molécule.
N2- : 8 électrons liants et 3 électrons anti-liants è nl = 1/2 ( 8 - 3 ) = 2,5
L'ajout d'un électron anti-liant déstabilise la molécule.
Il est évident sur le schémas que l'ajout d'un électron anti-liant est plus déstabilisant que l'enlévement d'un électron liant.
L'ordre de stabilité croissante est donc : N2- < N2+ < N2
Remarque : Le schéma avec interactions sp conduirait au mêmes conclusions.