THIERRY BRIERE - www.chimie-briere.com
Session de Juin 2004
Première Année D.E.U.G : SM - SV - ST - STPI - Chimie 21
Initiation à la Chimie Théorique - Atomistique - Thierry Briere
COMPOSES DU BORE ET DU FLUOR - SUJET
Rappels des constantes d'écran de Slater :
même groupe 0,35 (0,3 pour 1s) - groupe précédant : 0,85 - groupe interne : 1 - groupe externe : 0
Données théoriques :
E0 = 13,6 eV = 2,18 10-18 J - NA = 6,022 1023 mol-1 - e = 1,603 10-19 C
F = N * e = 96472 C.mol-1
A) Atomes de Bore et de Fluor
1) Déterminer les configurations électroniques du Bore (Z=5) et du Fluor (Z=9)
2) Calculer pour B et F la charge nucléaire effective Z* ressentie par un électron de leurs couches de valence.
B) Energies d'ionisation successives de l'atome de Bore :
Les données expérimentales sont les suivantes:
E.I.1 |
E.I.2 |
E.I.3 |
801 kJ.mol-1 |
2627 kJ.mol-1 |
3660 kJ.mol-1 |
1) Pour les deux premières ionisations : justifier sans calculs, que l'une est "anormalement élevée" alors que l'autre est "anormalement faible"
2) Calculer par utilisation du modèle de Slater l'énergie de troisième ionisation du Bore et comparer à la valeur expérimentale.
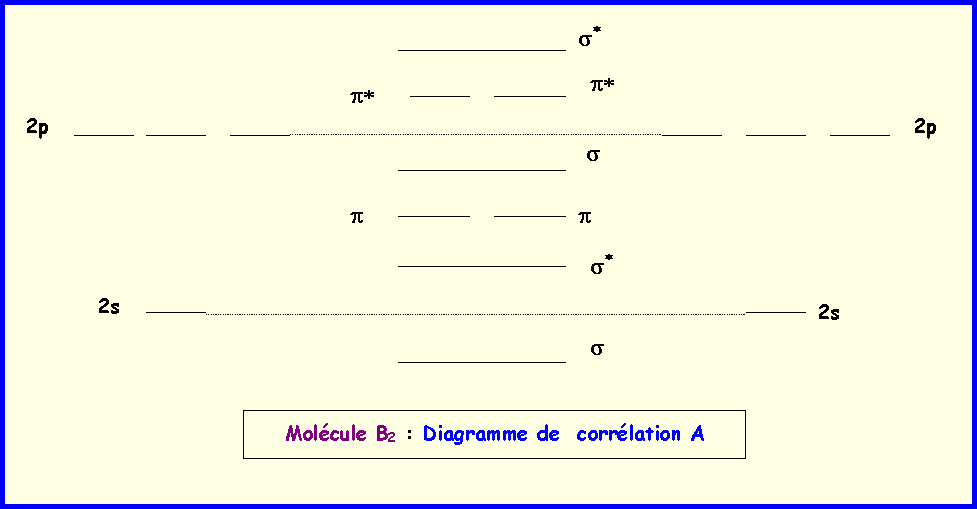
C) Molécules B2 et F2 :
1) Molécule B2 : Sachant que la molécule B2 est paramagnétique, montrer qualitativement qu'il y a nécessairement des interactions de type sp pour cette molécule. On donne les diagrammes de corrélations des orbitales qu'il faudra compléter. en faisant figurer les électrons. On précisera lequel des diagrammes A ou B correspond a la molécule réelle B2.

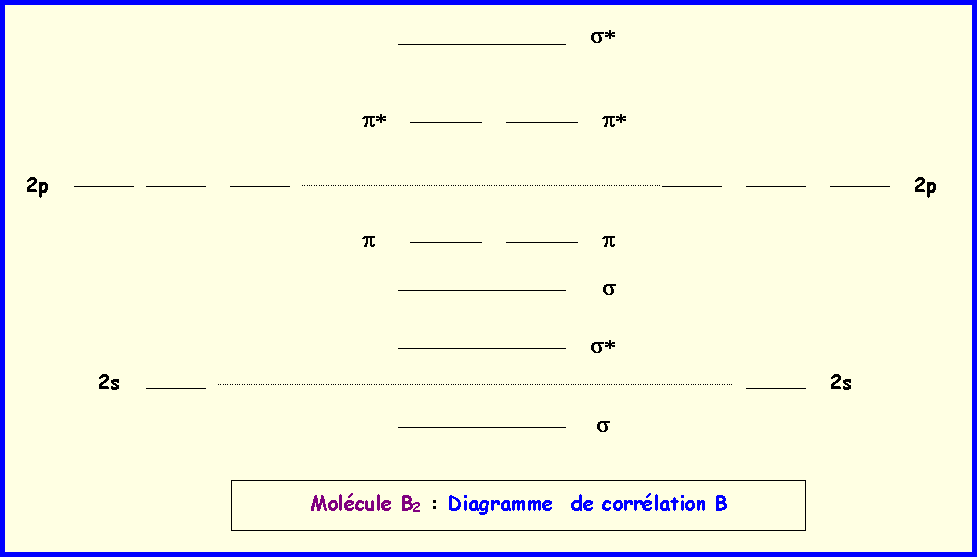
2) Molécule F2
a) Compléter le diagramme qualitatif des orbitales moléculaires de la molécule F2.
b) Comparer et classer les énergies de liaisons et les longueurs de liaison pour les molécules ou ions moléculaires F2 , F2+ et F2-.
D) Molécule BF3
La molécule BF3 présente trois liaisons B-F identiques dont la longueur expérimentale est de LB-F = 1,30 A°.
Indication supplémentaire : une des formes de Lewis n'est pas chargée mais ne suit pas la règle de l'octet, les trois autres sont chargées mais suivent bien la règle de l'octet. B et F appartenant tous deux à la deuxième période les formes chargées ont un "poids statistique" important bien que chargées et ne respectant pas l'ordre des électronégativités.
1) On rappelle la formule empirique de calcul du rayon de covalence d'un atome : R(A°) = 0,215 n2/Z* + 0,148 n + 0,225
Calculer les rayons de covalence de B et F
2) On rappelle la formule empirique de calcul des longueurs de liaison simple A-B à partir des rayons de covalence (en A°).
LA-B = 1,11(RA + RB) - 0,203
double liaison 86% de la simple - triple liaison 78% de la simple
Calculer la longueur d'une liaison B-F, simple, double et triple.
3) Montrer que la longueur expérimentale s'explique par l'intervention de plusieurs formes mésomères dont on écrira les schémas de Lewis.
4) Donner une représentation symbolique de l'hybride de résonance
5) Prévoir la géométrie de la molécule. La représenter dans l'espace et donner les valeurs des angles FBF.
6) Quel type d'hybridation peut-on attribuer à l'atome de Bore dans cette molécule ?
E) Ion BF4-
En présence d'ion fluorure, BF3 donne l'ion moléculaire BF4-.
1) Expliquer la formation de cet ion par un schéma décrivant la formation de la liaison BF supplémentaire.
2) De quel type de réaction s'agit-il ? Quel rôles jouent BF3 et F-.
THIERRY BRIERE - www.chimie-briere.com