CORRIGE DU SUJET DE CHIMIE THEORIQUE - ATOMISTIQUE
ETUDE DE L'ELEMENT ANTIMOINE
L'Antimoine Sb est l'élément de numéro atomique 51.
Son symbole Sb vient de Stibium car son principal minerai est la stibine qui est le sulfure d'antimoine. Cet élément est connu depuis très longtemps.
Dans les années 1600, on le confondait avec d'autre éléments comme l'Arsenic As ( Z = 33 ), l'Etain Sn ( Z = 50 ), le Plomb Pb ( Z = 82 ) et le Bismuth Bi (Z = 83).
Il présente des propriétés chimiques très proches de celle de l'Arsenic.
Cet élément est un semi-métal, c'est à dire qu'il possède des propriétés intermédiaires entre métaux et métalloïdes et se comporte à la fois comme un métal et/ou comme un non métal. Il est en particulier utilisé dans la fabrication de semi-conducteurs.
Cet élément existe au degrés d'oxydation +III ; -III et +V.
Il existe deux isotopes stables de cet élément de nombre de masse 121 et 123. La masse molaire de l'élément naturel est de 121,8 g mol-1.
Il existe d'autre part, 4 isotopes radioactifs de nombre de masse 120, 122, 124 et 125.
Trois de ces isotopes sont des émetteurs de type b- alors que le quatrième est de type b+.
Les 6 premières énergies d'ionisation (exprimées en eV) de l'antimoine sont les suivantes :
8,6 - 16,5 - 25,3 - 44,2 - 56 et 108 eV.
Le Z* de l'antimoine est Z*Sb = 6,3, son rayon de covalence est de 1,43 A° et son électronégativité dans l'échelle d'Alred et Rochow est de XSb =1,82.
Le rayon ionique trouvé dans une table est de 2,45 A°.
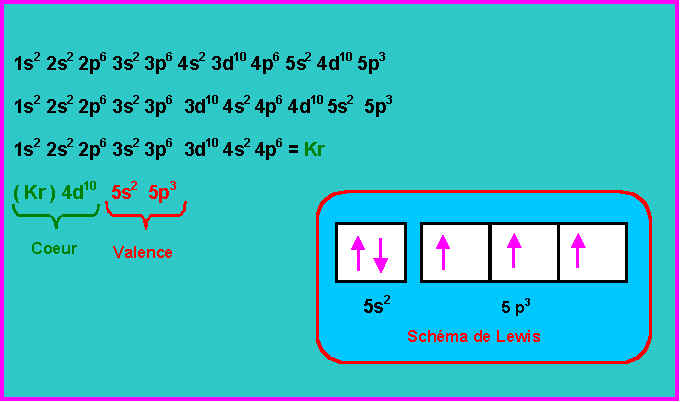
1) Donner la configuration électronique de l'élément Antimoine.
On donnera la configuration complète puis la notation simplifiée de celle ci sous la forme :
(gaz rare) ; couche externes.
On précisera la couche de valence de cet élément.
On représentera son schéma de Lewis atomique.

2) On a représenté les contours de la classification périodique. Y situer l'élément Antimoine.

3) Justifier simplement le fait que l'on confondait autrefois As, Pb, Sn, Bi et Sb. Placer ces divers éléments dans la classification.
As, Sb et Bi appartiennent au même groupe (ou famille, ou colonne) de la classification périodique, ils ont des couches de valence de même type (s2p3) et possèdent donc des propriétés chimiques similaires.
Il en va de même pour Pb et Sn qui eux sont en s2p2.
Nous avons donc affaire à 5 éléments appartenant à deux groupes ne différant que par un électron dans la couche de valence.
La différence des propriétés chimiques entre deux groupes situés l'un a coté de l'autre dans la classification n'étant pas très importante, il est normal qu'on ai eu du mal à distinguer tous ces éléments au tout début de la chimie.
En résumé on peut dire que ces éléments étant très proches les uns des autres dans la classification auront des propriétés peu différentes.
4) Citer 4 éléments appartenant au même groupe que l'antimoine.
Azote N - Phosphore P - Arsenic As - Bismuth Bi
5) Selon la règle de Sanderson, l'Antimoine est-il un métal ou un non-métal ?
La couche de n le plus élevé (n = 5) possède 5 électrons (5s2 5p3).
Sb appartient à la cinquième période.
Sb est donc un métal d'après la règle de Sanderson.
6) Justifier l'existence des trois degrés d'oxydation différents de cet élément en expliquant la formation des ions correspondants.
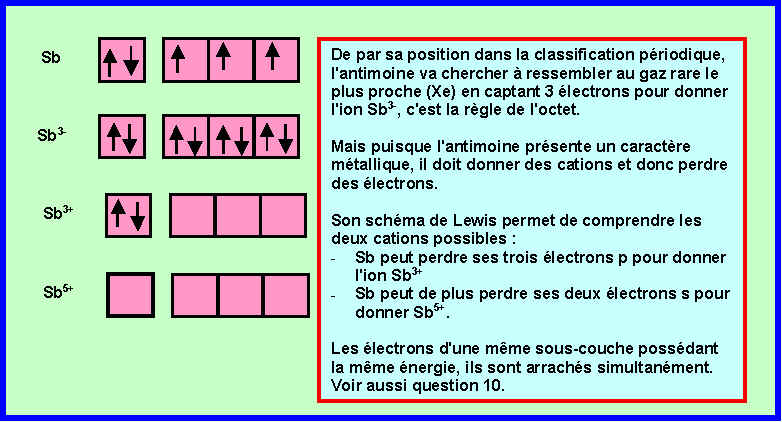
7) L'existence de ces trois ions permet-elle de conclure sur la nature métallique ou non de l'Antimoine ?
Les métaux donnent des cations et les non-métaux des anions.
L'Antimoine donnant à la fois un anion Sb3- et des cations Sb3+ et Sb5+ est à la fois un métal et un non-métal.
On ne peut donc pas trancher sur sa nature métallique ou non.
8) Evaluer l'abondance naturelle des deux isotopes stables.
M = S xi Mi
S xi = 1
121,8 = 121 x1 + 123 x2 = 121 x1 + 123 (1 - x1) = 121 x1 + 123 - 123 x1 = 123 - 2 x1
121,8 - 123 = - 1,2 = -2 x1 Û x1 = 0,6
121Sb : x1 = 0,6 (60%)
123Sb : x2 = 0,4 (40%)
9) Parmi les 4 isotopes radioactifs préciser en justifiant la réponse lequel est l'émetteur b+.
Un émetteur de type b+ émet des positrons, cela correspond à la transformation d'un proton en neutron.
Les émetteurs b+ possèdent donc" trop de protons et pas assez de neutrons"
( N < Z ).
C'est donc l'isotope de nombre de masse le plus faible (N le plus petit) qui sera l'émetteur b+, ici 120Sb.
10) On a représenté graphiquement l'évolution des 6 premières énergies d'ionisation de l'Antimoine. Commentez brièvement cette évolution. On précisera en particulier la sous-couche des électrons arrachés successivement .
E.I |
Sous couche |
|
1 |
8,6 |
5p |
2 |
16,5 |
5p |
3 |
25,3 |
5p |
4 |
44,2 |
5s |
5 |
56 |
5s |
6 |
108 |
4d |
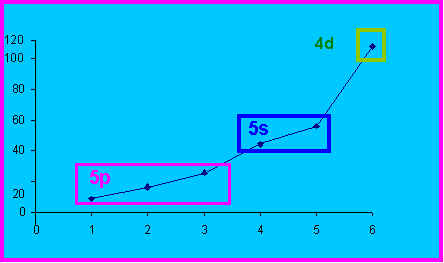
On arrache les électrons dans l'ordre inverse de leurs énergies.
Les électrons d'une même sous-couche ayant des énergies identiques, on retrouve les diverses sous-couches sur le graphique. Le changement de sous-couche se manifeste par un changement de pente.
Ici on arrache d'abord les trois électrons p (EI1, EI2 et EI3) puis les deux électrons s (EI4 et EI5) et enfin les électrons 4d (E.I6).
Un saut est observé quand on quitte la couche de valence pour arracher des électrons de coeur (E.I6).
11) Evaluer le rayon de covalence de l'Antimoine et comparer la valeur obtenue à la valeur expérimentale.
On applique la formule donnée avec n* = 4, on trouve R = 1,35 A°.
Soit un écart de 5% avec la valeur expérimentale.
12) Evaluer son électronégativité dans l'échelle d'Alred et Rochow et comparer à la valeur expérimentale.
On applique la formule donnée.
On peut utiliser la valeur calculée pour le rayon de covalence R = 1,35 A°, on trouve alors
X = 1,9.
On peut utiliser la valeur tabulée pour le rayon de covalence R = 1,43 A°, on trouve alors
X = 1,7.
L’écart est ici aussi d’environ 5%.
13) Quel est l'ion dont le rayon est donné ? (R = 2,45 A°)
Le rayon ionique est plus grand que le rayon de covalence de l’atome neutre, l’ion est donc l’anion Sb3-.
14) Quelle sont les formules possibles pour la stibine ?
Le Soufre donne l’ion Sulfure S2-.
L’Antimoine sera donc sous forme de cation Sb3+ ou Sb5+
De plus le composé ionique doit être électriquement neutre.
Les deux formules possibles sont donc :
- Sb3+ et S2- : Sb2S3
- Sb5+ et S2- : Sb2S5