DECEMBRE 98
SUJET DE CHIMIE THEORIQUE - ATOMISTIQUE
RAPPELS - FORMULAIRES - DONNEES
Formule d'évaluation du rayon de covalence :
Rcov (A°) = 0,215 n*2/Z* + 0,145 n* + 0,223
Avec n* = n pour n=2 et n = 3 ; n* = 3,7 pour n=4 et n* = 4 pour n = 5
Echelle d'Alred et Rochow : X = 0,34 Z*/R2 + 0,67
Règle de Sanderson : Un élément est métallique si le nombre d ’électron de sa couche de n le plus élevé est inférieur ou égal au numéro de sa période.
ETUDE DE L'ELEMENT ANTIMOINE
L'Antimoine Sb est l'élément de numéro atomique 51.
Son symbole Sb vient de Stibium car son principal minerai est la stibine qui est le sulfure d'antimoine. Cet élément est connu depuis très longtemps.
Dans les années 1600, on le confondait avec d'autre éléments comme l'Arsenic As ( Z = 33 ), l'Etain Sn ( Z = 50 ), le Plomb Pb ( Z = 82 ) et le Bismuth Bi (Z = 83).
Il présente des propriétés chimiques très proches de celle de l'Arsenic.
Cet élément est un semi-métal, c'est à dire qu'il possède des propriétés intermédiaires entre métaux et métalloïdes et se comporte à la fois comme un métal et/ou comme un non métal. Il est en particulier utilisé dans la fabrication de semi-conducteurs.
Cet élément existe au degrés d'oxydation +III ; -III et +V.
Il existe deux isotopes stables de cet élément de nombre de masse 121 et 123. La masse molaire de l'élément naturel est de 121,8 g mol-1.
Il existe d'autre part, 4 isotopes radioactifs de nombre de masse 120, 122, 124 et 125.
Trois de ces isotopes sont des émetteurs de type b- alors que le quatrième est de type b+.
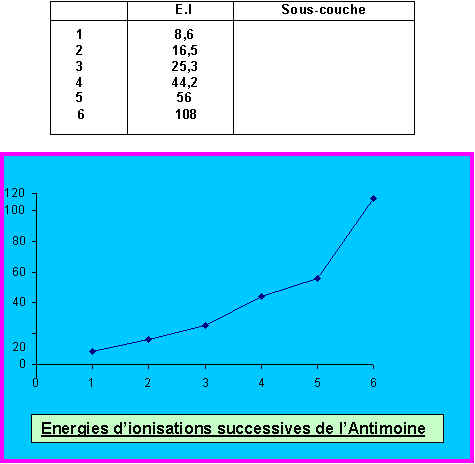
Les 6 premières énergies d'ionisation (exprimées en eV) de l'antimoine sont les suivantes :
8,6 - 16,5 - 25,3 - 44,2 - 56 et 108 eV.
Le Z* de l'antimoine est Z*Sb = 6,3, son rayon de covalence est de 1,43 A° et son électronégativité dans l'échelle d'Alred et Rochow est de XSb =1,82.
Le rayon ionique trouvé dans une table est de 2,45 A°.
QUESTIONS :
On donnera la configuration complète puis la notation simplifiée de celle ci sous la forme :
(gaz rare) ; couche externes.
On précisera la couche de valence de cet élément.
On représentera son schéma de Lewis atomique.
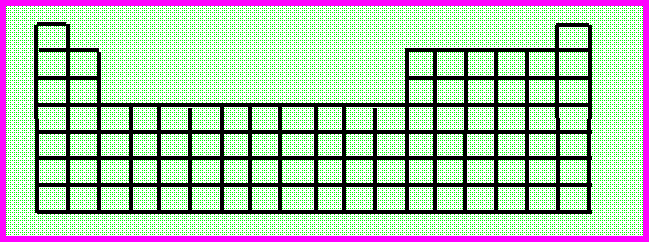
2) On a représenté les contours de la classification périodique. Y situer l'élément Antimoine.

3) Justifier simplement le fait que l'on confondait autrefois As, Pb, Sn, Bi et Sb. Placer ces divers éléments dans la classification.
4) Citer 4 éléments appartenant au même groupe que l'antimoine.
5) Selon la règle de Sanderson, l'Antimoine est-il un métal ou un non-métal ?
6) Justifier l'existence des trois degrés d'oxydation différents de cet élément en expliquant la formation des ions correspondants.
7) L'existence de ces trois ions permet-elle de conclure sur la nature métallique ou non de l'Antimoine ?
8) Evaluer l'abondance naturelle des deux isotopes stables.
9) Parmi les 4 isotopes radioactifs préciser en justifiant la réponse lequel est l'émetteur b+.
10) On a représenté graphiquement l'évolution des 6 premières énergies d'ionisation de l'Antimoine. Commentez brièvement cette évolution. On précisera en particulier la sous-couche des électrons arrachés successivement .
11) Evaluer le rayon de covalence de l'Antimoine et comparer la valeur obtenue à la valeur expérimentale.
12) Evaluer son électronégativité dans l'échelle d'Alred et Rochow et comparer à la valeur expérimentale.
13) Quel est l'ion dont le rayon est donné ? (R = 2,45 A°)
14) Quelle sont les formules possibles pour la stibine ?