SEPTEMBRE 2000 – Rattrapage Première Période – ATOMISTIQUE
CORRIGE
Question de cours :
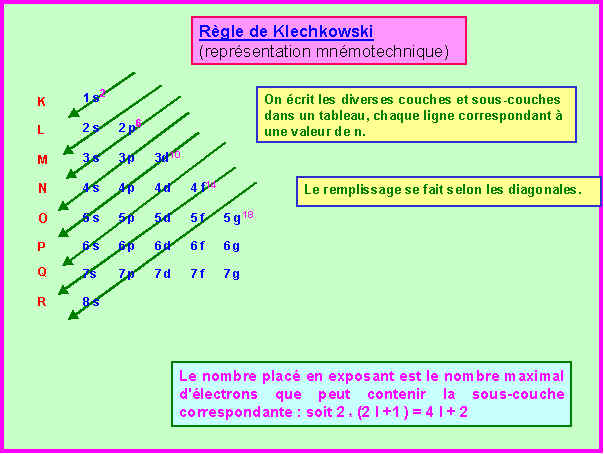
La règle de Klechkowski.
a) Enoncez cette règle
L'ordre de remplissage des diverses couches et sous-couches se fait par valeurs croissantes du couple (n+l). Si deux ou plusieurs couples conduisent à la même somme ils seront classés par ordre croissant de la valeur de n.

Donnez la configuration électronique des éléments suivants : N (Z=7) - Ba(Z=57)
N : (He) 2s2 2p3 - Ba : (Xe) 4f1 6s2
Exercice :
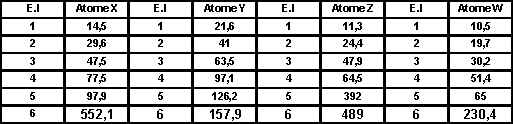
Soit 4 éléments X, Y, Z et W.
On sait que ces 4 éléments sont situés dans les 3 premières lignes de la classification périodique.
On donne les 6 premières énergies d’ionisation (en eV) de ces quatre éléments.
On donne d’autre part une représentation graphique de la variation de ces énergies d’ionisation.
Voir tableau et courbes pages suivantes.
Electronégativité d'Alred et Rochow : XA.R = 0,34 [ Z* / RCov2 ] + 0,67 (Rcov en A°)
Rayon de covalence des atomes : RCov (A°) = 0,215 n2 / Z* + 0,145 n + 0,225
1) Pour trois de ces éléments (X,Z et W) il est facile d'identifier à quelle colonne de la classification périodique ils appartiennent. Attribuer sa colonne à chacun en justifiant votre réponse.
On arrache successivement les électrons de l'atome pour obtenir les ions correspondants, quand l'ion obtenu possède la structure électronique d'un gaz rare il est particulièrement stable (règle de l'octet) et il sera donc très difficile de lui arracher un nouvel électron.
Cela se manifeste par une brusque augmentation de l'énergie d'ionisation visible par un "saut" sur le graphique.
La position du "saut" permet donc d'identifier le groupe auquel appartient l'élément.
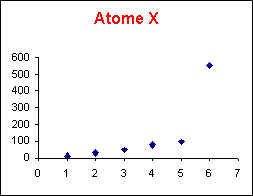
Elément X : Le saut se produit entre la 5ème et la 6ème ionisation, l'ion X5+ est donc très stable et possède la structure d'un gaz rare. L'élément X appartient donc à la colonne 15 de la classification périodique.
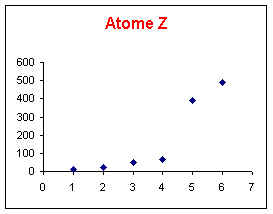
Elément Z : Le saut se produit entre la 4ème et la 5ème ionisation, l'ion Z4+ est donc très stable et possède la structure d'un gaz rare. L'élément Z appartient donc à la colonne 14 de la classification périodique.
Elément W : Le saut se produit entre la 5ème et la 6ème ionisation, l'ion W5+ est donc très stable et possède la structure d'un gaz rare. L'élément W appartient donc à la colonne 15 de la classification périodique.
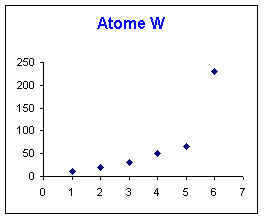
2) Pour un de ces éléments (Y) il est difficile d'identifier la colonne. Des mesures de magnétisme permettent de déterminer que cet atome Y ne possède aucun électron célibataire. Identifiez la colonne d'appartenance de cet élément grâce à ce renseignement supplémentaire.
Le saut n'est pas visible sur le graphique, il doit donc se produire après la 6ème ionisation. L'élément Y doit donc appartenir aux colonnes 16, 17 ou 18.
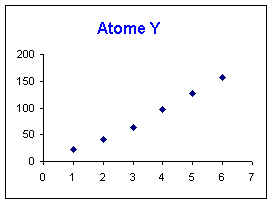
Les configurations électroniques correspondantes sont :
Colonne 16 : s2 p4 - 2 électrons célibataires
Colonne 17 : s2 p5 - 1 électron célibataire
Colonne 18 : s2 p6 - pas d'électrons célibataires
L'élément Y est donc un gaz rare de la colonne 18.
3) Deux de ces éléments (X et W) appartiennent à un même groupe de la classification, comment cela se traduit-il sur la représentation graphique ? Justifiez. Attribuer à ces deux atomes leur symbole et leur nom en justifiant votre réponse.
On observe un parallélisme évident entre les deux représentations graphiques.
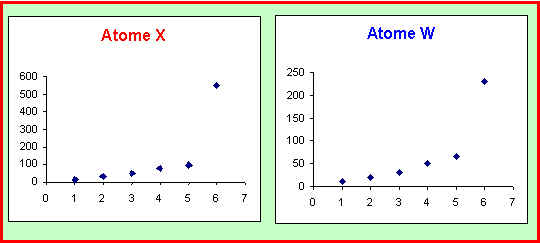
Les éléments d'un même groupe possèdent des configurations électroniques du même type et donc des propriétés voisines. L'évolution de leurs énergies d'ionisation successives est donc semblable.
Les énergies d'ionisation de X sont toujours supérieures à celles de W.
L'énergie d'ionisation augmente de Gauche à Droite et de Bas en Haut dans la classification périodique. X et W appartiennent au même groupe, X est donc placé plus haut que W.
X est donc l'Azote (N) et W le Phosphore (P).
5) Elément Y : Quelles sont les diverses possibilités pour cet élément ? Pour lever l’indétermination calculer l’énergie de cinquième ionisation pour les deux possibilités et comparer les résultats obtenus à la valeur expérimentale. Conclure sur la nature de Y.
Y est un gaz rare.
Y est donc soit l'Hélium He, soit le Néon Ne, soit l'Argon Ar.
On donne les 6 première énergie d'ionisation de Y, l'Hélium ( Z = 2 ) est donc exclu.
L'énergie de 6ème ionisation correspond au passage de A4+ à A5+.

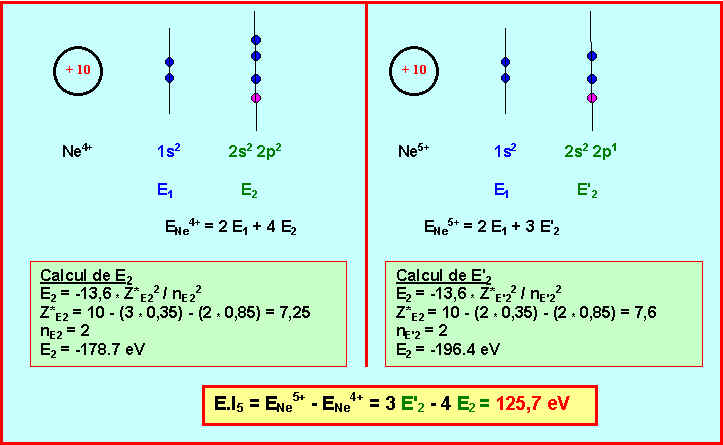

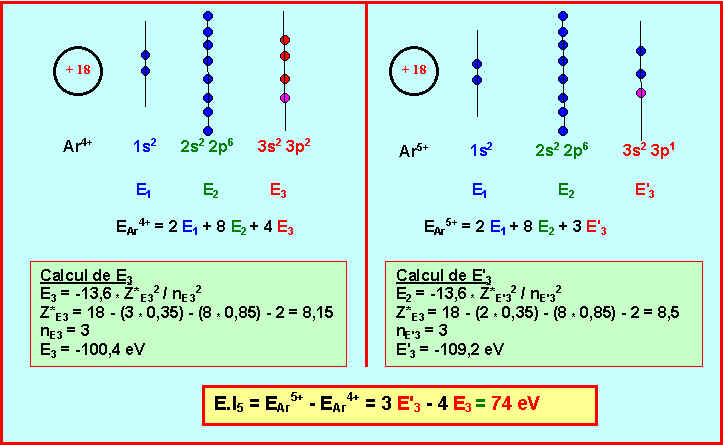
La valeur expérimentale pour l'atome Y est de E.I5 = 126,2 eV.
L'élément Y est donc le Néon Ne.
6) Elément Z : Quelles sont les diverses possibilités pour cet élément ?
Identifiez cet élément sachant que son électronégativité est de 2,5 dans l’échelle d’Alred et Rochow.
L'élément Z appartenant à la colonne 14 peut être le Carbone ou le Silicium.
Cas du Carbone C :
C : Z = 6 - 1s2 2s2 2p2
Z* = 6 - ( 3 * 0.35 ) - (2 * 0,85 ) = 3,25
R = 0,7796 A°
X = 2,49
Cas du Silicium
Si : Z = 14 - 1s2 2s2 2p6 3s2 3p2
Z* = 14 - ( 3 * 0.35 ) - (8 * 0,85 ) - 2 = 4,15
R = 1,126 A°
X = 1,8
Z est donc le Carbone C.