LES ALCALINS
FORMULAIRE – RAPPELS - DONNEES :
On donne la valeur du Z* de Slater pour certains éléments des blocs s et p de la classification périodique :
| H (1) | He (1,70) | ||||||
| Li (1,3) | Be (1,95) | B (2,60) | C (3,25) | N (3,90) | O (4,55) | F (5,2) | Ne (5,85) |
| Na (2,2) | Mg (2,85) | Al (3,5) | Si (4,15) | P (4,80) | S (5,45) | Cl (6,1) | Ar (6,75) |
| K (2,2) | Ca (2,85) | Ga (5,00) | Ge (5,65) | As (6,30) | Se (6,95) | Br (7,6) | Kr (8,25) |
| Rb (2,2) | Sr (2,85) | In (5,00) | Sn (5,65) | Sb (6,30) | Te (6,95) | I (7,60) | Xe (8,25) |
NOTA : Le Z* des ions pourra être calculé directement à partir des valeurs des Z* des éléments.
Constantes diverses :
Constante de Planck : h = 6,63 10-34 J s
Charge de l’électron : e = 1,6 10-19 C
Nombre d’Avogadro : N = 6,022 1023
Célérité de la lumière dans le vide : C = 3 108 m s-1
Masse de l'électron : me = 9,1 10-31 kg
Masse du proton : mp = 1,6725 10-27 kg =1,00727 u.m.a
Masse du neutron : mn = 1,6747 10-27 kg = 1,00866 u.m.a
QUESTIONS :
He (2) - Ne(10) - Ar (18) - Kr (36) - Xe (54) - Rn (86)
Il suffit d'ajouter 1 pour obtenir le Z des alcalins.
NOM |
SYMBOLE |
Z |
Configuration |
Lithium |
Li |
3 |
[He] 2s1 |
Sodium |
Na |
11 |
[Ne] 3s1 |
Potassium |
K |
19 |
[Ar] 4s1 |
Rubidium |
Rb |
37 |
[Kr] 5s1 |
Césium |
Cs |
55 |
[Xe] 6s1 |
Francium |
Fr |
87 |
[Rn] 7s1 |
La masse molaire atomique du Sodium est très proche (mais légèrement inférieure) de la valeur entière 23.
Cela est normal car la masse de l'atome est essentiellement concentrée dans son noyau (masse des électrons négligeables). D'autre part, la masse du proton et celle du neutron sont sensiblement égales et très proches de 1 u.m.a. Le noyau contenant Z protons et N neutrons, sa masse est donc sensiblement égale à (Z + N) u.m.a. (Le nombre Z + N est appelé nombre de masse et symbolisé par la lettre A).
Comme les masses du proton et du neutron sont légèrement supérieures à 1 u.m.a et que la masse des électrons s'ajoute à celle du noyau, on devrait observer une masse atomique supérieure au nombre de masse et non inférieure comme cela est le cas
On doit aussi tenir compte de l'énergie de liaison du noyau qui se traduit par un défaut de masse (la masse réelle du noyau est toujours inférieure à celle de ses composants).
Enfin, la masse molaire s'exprime par le même nombre en unité de masse atomique ou en g mol-1.
Compte tenu de toutes ces considérations, la masse molaire d'un isotope déterminé est donc toujours très proche de la valeur entière de son nombre de masse.
La masse molaire de l'élément naturel s'exprime par : M = S xi Mi
xi représente la fraction molaire (ou le pourcentage en nombre d'atomes au facteur 100 près) de l'isotope i de masse molaire Mi.
La masse molaire Mi d'un isotope donné est sensiblement égale au nombre de masse de cet isotope.
Dans le cas du potassium on peut donc écrire : MK = 39 * x1 + 41 * x2
Selon les valeurs attribuées à x1 et x2 on obtient deux solutions :
* x1 = 0,9309 et x2 = 0,0691 : M = 0,9309 * 39 + 0,0691 * 41 = 39,13
* * x1 = 0,0691 et x2 = 0,9309: M = 0,9309 * 41 + 0,0691 * 39 = 40,86
Il est évident que seule la première solution correspond (aux approximations prés) à la masse molaire expérimentale du potassium naturel.
Soit pour les abondances naturelles des deux isotopes du Potassium :
41K : 6,91 % et 39K : 93,09 %
6)
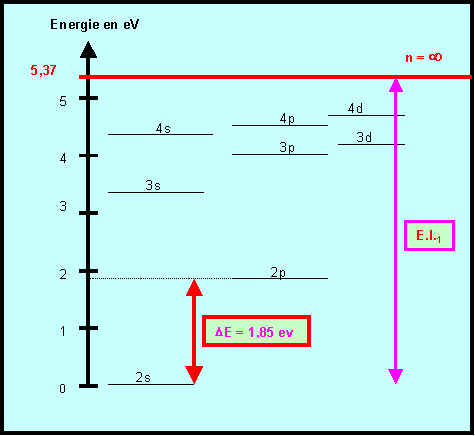
Le Lithium présente dans son spectre d’émission une raie rouge intense de longueur d’onde 671 nm.
Calculer l’énergie associée à cette longueur d’onde.
L'énergie associée à une radiation lumineuse est proportionnelle à sa fréquence n et inversement proportionnelle à sa longueur d'onde l :
E = h n = h C / l
E = ( 6,62 10-34 * 3 108 ) / 671 10-9 = 2,96 10-19 J = 1,85 eV
La figure suivante donne les niveaux d’énergies de l’atome de Lithium déterminés à partir de son spectre d’émission.

Pourquoi le niveau 2s est-il pris comme niveau zéro pour l’énergie ?
La configuration du Lithium est [He] 2s1 ou 1s2 , 2s1
Le niveau 2s est donc le dernier niveau occupé dans l'état fondamental de l'atome de Lithium.
Ce sont les électrons situés sur ce niveau qui pourront " sauter " sur un niveau supérieur par excitation, il est donc pris comme référence pour l'énergie. C'est le niveau fondamental de l'atome de lithium.
Il s'agit de l'énergie d'ionisation de l'atome de Lithium à partir de son état fondamental 2s1, c'est l'énergie qu'il faut fournir pour amener l'électron du niveau fondamental à l'infini c'est à dire pour ioniser Li en Li+. (voir figure)
La transition dont l’énergie vaut 1,85 eV est la transition entre les niveaux 2s et 2p
(voir figure)
8) Le Francium est le métal alcalin le plus lourd connu. Il a été découvert par Perey en 1939.
Ce métal est radioactif et ne possède aucun isotopes stables.
On obtient un de ses isotopes 223Fr par la désintégration spontanée de type a d'un isotope radioactif de l'Actinium (Z = 89). L'isotope du francium obtenu se transforme par radioactivité de type b- en un isotope du Radium.
Ces deux transformation successives sont schématisées dans la figure suivante :

On demande de déterminer les valeurs de x, y, t et u.
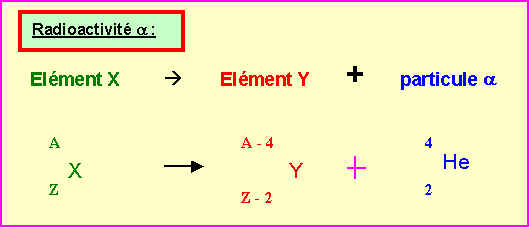
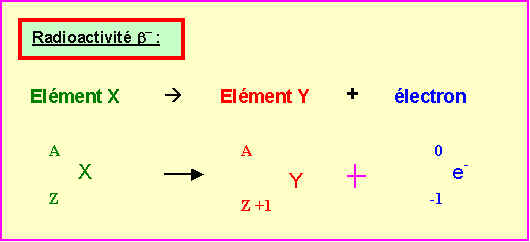
223 = x – 4 Û x = 227
y = 89 – 2 Û y = 87
u = y + 1 Û u = 88
t = 223
9)
Le tableau suivant donne : le rayon de covalence et le rayon ionique (en A°) et les énergies de première ionisation (E.I.1) et de deuxième ionisation (E.I.2) en KJ mol-1 des 4 premiers alcalins.
Rayon Covalent (A°) |
Rayon Ionique (A°) |
E.I 1 (KJ mol-1) |
E.I 2 (KJ mol-1) | |
Lithium |
1,23 |
0,60 |
520,3 |
7298 |
Sodium |
1,54 |
0,95 |
495,8 |
4562 |
Potassium |
2,03 |
1,33 |
419 |
3051 |
Rubidium |
2,16 |
1,48 |
403 |
2632 |
Rappeler l’expression des rayons des orbites permises pour l’électron des atomes hydrogénoïdes obtenue dans le modèle de Bohr.
R = (h2 e0 / p m e2) [ n2 / Z ] = a0 [ n2 / Z ]
Avec a0 = h2 e0 / p m e2 = 0,529 A°
Que devient cette expression dans le modèle de Slater ?
On remplace seulement Z par Z* (et éventuellement n par n*).
R = a0 [ n*2 / Z* ]
A partir de cette expression justifier l’évolution observée du rayon de covalence des alcalins.
Le rayon varie comme n*2/Z*.
Dans une colonne n augmente d’une unité quand on passe d’un élément au suivant.
Dans le même temps le Z* des éléments augmente très légèrement puis devient constant (voir tableau des valeurs de Z*).
L’élévation de n2 tend a faire augmenter la taille de l’atome, l’augmentation parallèle de Z* tend à la diminuer. Comme l’augmentation de n2 l’emporte largement sur celle du Z* on observe une augmentation régulière du rayon atomique quand on descend dans une même colonne de la classification.
Justifier le fait que le rayon ionique des alcalins est très inférieur à leur rayon de covalence.
L’alcalin M de configuration électronique [gaz rare] ns1 cherche à se stabiliser en perdant son électron de valence ns1. On obtient ainsi un cation M+ ayant la structure d’un gaz rare.
On suppose que la relation R = a0 n2/Z* reste valable pour l’ion obtenu voyons comment évoluent n et Z* quand on passe de M à M+.
Exemple :
Na : n = 3 et Z* = 2,2 Þ n2 / Z* = 9 / 2,2 = 4,09
Na+ : n = 2 et Z* = 6,85 ( =Z*Ne+1 ) Þ n2/Z* = 4 / 6,85 = 0,58
Quel lien qualitatif peut-on faire entre le rayon atomique et l’énergie de première ionisation ?
Plus un atome est " petit " et plus les électrons de valence sont près du noyau. Ils sont donc bien retenus par celui-ci et seront donc difficiles à arracher soit une énergie d’ionisation élevée.
Plus un atome est " gros " et plus les électrons de valence sont loin du noyau. Ils sont donc mal retenus par celui-ci et seront donc faciles à arracher soit une énergie d’ionisation faible.
L’énergie d’ionisation varie donc en sens inverse du rayon atomique.
Justifier l’évolution observée pour l’énergie de première ionisation des alcalins.
Le rayon atomique augmentant, parallèlement l’énergie d’ionisation diminue quand on passe de Li à Rb.
Expliquer pourquoi l’énergie de deuxième ionisation d’un atome est forcément plus grande que son énergie de première ionisation.
On peut raisonner de plusieurs manières :
Dans le cas des alcalins on observe que l’énergie de deuxième ionisation est beaucoup plus élevée que l’énergie de première ionisation. Comment peut-on justifier cela ?
Les alcalins en perdant leur unique électron n s acquièrent la structure électronique d’un gaz rare. Cette structure à 8 électrons de valence est très stables (sous-couches s et p totalement remplies. (règle de l’octet)
Puisque l’ion obtenu est très stable ce processus est énergétiquement très favorisé. L’énergie de première ionisation des alcalins sera donc particulièrement faible.
A l’inverse, il sera extrêmement difficile d’arracher un deuxième électron et l’énergie de deuxième ionisation des alcalins sera particulièrement élevée.
La combinaison de ces deux facteurs : E.I.1 faible et E.I.2 élevée fait que l’énergie d’ionisation des alcalins est beaucoup plus élevée que leur énergie de première ionisation.
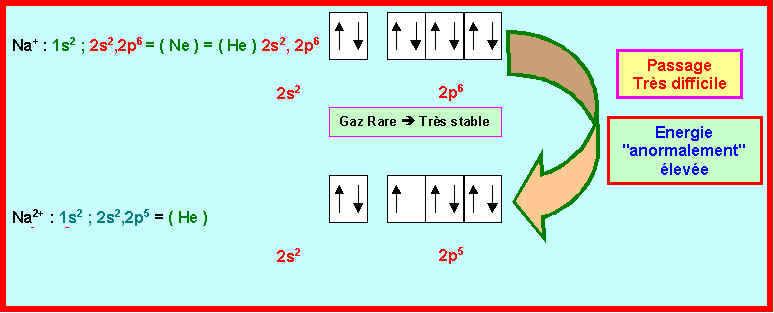
En utilisant le modèle de Slater calculer les deux premières énergies d’ionisation de l’atome de Sodium et comparer aux valeurs expérimentales. On justifiera les écarts observés à partir des schémas de Lewis atomiques.
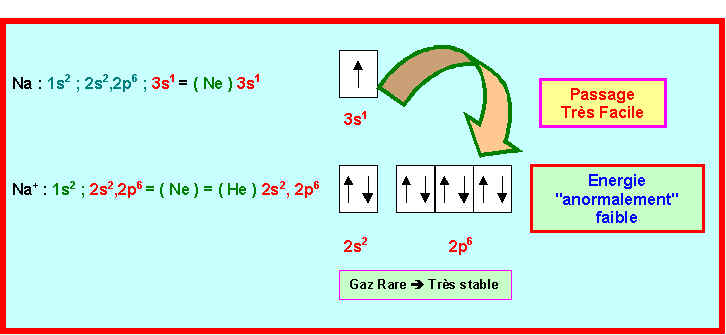
Na : Z = 11 Þ 1s2 ; 2s2,2p6 ; 3s1
Na+ : Z = 11 Þ 1s2 ; 2s2,2p6
Na2+ : Z = 11 Þ 1s2 ; 2s2,2p5

Energie de première ionisation :
Na à Na+ + e-
E.I.1 = ENa+ - ENa = - E3
Calcul de E3 :
E3 = (-13,6 * 2,22) / 9 = - 7, 3 eV
E.I.1 = 7,3 eV = 7,3 * 96,5 = 706 kJ mol-1
Expérimental : 496 kJ mol-1 soit 100 * (706 - 496) / 496 = 42 % d'écart
Cet écart énorme entre valeur calculée et valeur expérimentale peut être expliqué en comparant les schémas de Lewis atomiques de Na et Na+.
Na+ ayant la structure électronique d'un gaz rare sera très stable.
Na perd donc très facilement un électron et son énergie d'ionisation est particulièrement faible. Il est donc normal que la valeur calculée ( 706 kJ mol-1 ) soit nettement plus élevée que la valeur expérimentale ( 496 kJ mol-1).
Energie de deuxième ionisation :
Na+ à Na2+ + e-
E.I.2 = ENa2+ - ENa+ = 7 E'2 - 8 E2
Calcul de E2 :
Z* Na+ = Z*Ne + 1 = 6,85
E2 = (-13,6 * 6,852) / 4 = - 159,5 eV
Calcul de E'2 :
Z* Na2+ = Z*F + 2 = 7,2
E'2 = (-13,6 * 7,22) / 4 = - 176,2 eV
Calcul de E.I.2
E.I.2 = ( 7 * - 176,2) - ( 8 * -159,5 ) = 42,6 eV = 4111 KJ mol-1
Expérimental : 4562 kJ mol-1 soit un écart de : 100 * (4111 - 4562) / 4562 = -10 % d'écart
Cet écart assez important entre valeur calculée et valeur expérimentale peut être expliqué en comparant les schémas de Lewis atomiques de Na+ et Na2+.
Na+ ayant la structure électronique d'un gaz rare est très stable.
Na+ perdra donc très difficilement un électron et son énergie d'ionisation sera particulièrement élevée. Il est donc normal que la valeur calculée ( 4111 kJ mol-1 ) soit nettement moins élevée que la valeur expérimentale ( 4562 kJ mol-1).
- Evaluation des rayons ioniques (méthode de Pauling) :
Dans le Chlorure de Potassium KCl la distance internucléaire K-Cl est de 3,14 A°.
Evaluer les rayons ioniques de K et de Cl.
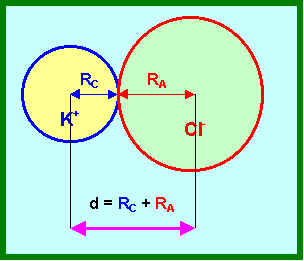
On suppose que le rayon des ions est comme celui des atomes proportionnel à n2/Z*.
RA = k nA2 / Z*A
RC = k nC2 / Z*C
RA / RC = ( nA2 / nC2 ) ( Z*C / Z*A ) = K
RA = K RC
d = RA + RC = K RC + RC = RC ( 1 + K )
RC = d / ( 1 + K )
RA = K d / ( 1 + K )
Application numérique :
