SUJET DE CHIMIE THEORIQUE-ATOMISTIQUE
SESSION DE JUIN 99 – Deuxième période
LES MOLECULES
CORRIGE
COMPOSES DE L’AZOTE ET DU CARBONE
DONNEES :
On rappelle la formule empirique permettant le calcul approché des longueurs de liaisons à partir des rayons de covalence calculés des atomes :
Liaison simple : LAB = 1,11 (RA + RB ) - 0,203
Liaison double : 86% de la simple
Liaison triple : 78% de la simple
On donne les rayons de covalence calculés pour C, N et H :
RC = 0,7856 A° - RN = 0,7415 A° - RH = 0,346 A°
Le composé le plus simple entre l’azote et le carbone est le composé de formule CN.
Ce composé est très instable mais a néanmoins été détecté dans l’espace interstellaire et dans l’atmosphère de certaines comètes. Les données expérimentales concernant ce composé montre que la longueur de la liaison CN est de 1,1718 A°.
1) Utilisation du modèle de Lewis
1-1)
Le nombre total d’électron est impair et il y a donc un électron célibataire dans cette molécule.
Il s’agit d’un RADICAL.
PARAMAGNETISME.
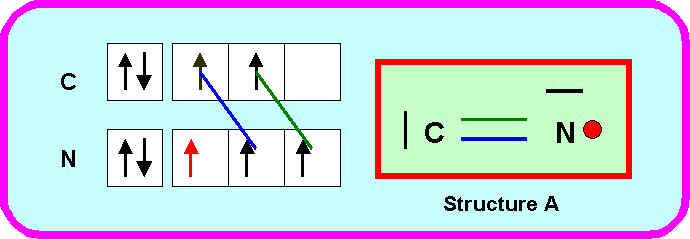
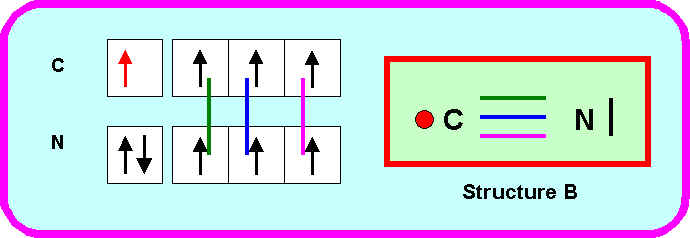
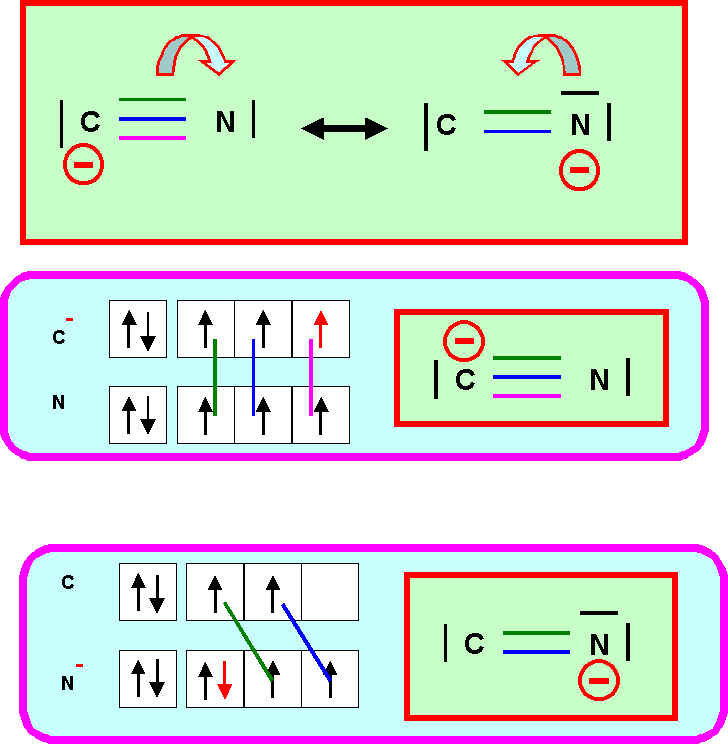
Proposez pour ce composé deux structures de Lewis différentes dans lesquelles on attribuera l’électron célibataire à l’atome d’Azote (structure A) ou à l’atome de carbone (structure B).
On se limitera aux seules formes mésomères NON CHARGEES

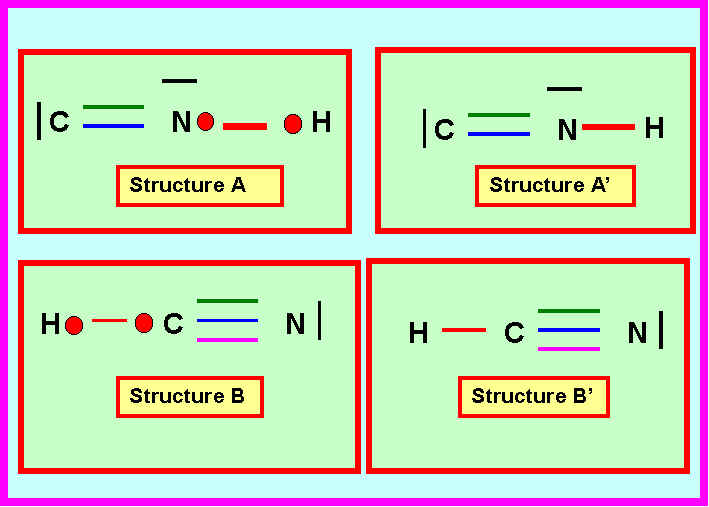
A partir du radical CN on peut facilement obtenir un composé hydrogéné NCH (éléments classés dans l'ordre alphabétique de leur nom)
Longueur des liaisons :
Liaison N – H :
LNH = 1,11 ( 0,7415 + 0,346) - 0,203 = 1,004 A°
Liaison C = N :
LC=N = 0,86 * [ 1,11 (0,7856+ 0,7415) - 0,203 ] = 1,283 A°
Longueur des liaisons :
Liaison C H :
LCH = 1,11 ( 0,7856 + 0,346) - 0,203 = 1,053 A°
Liaison CN
LCN = 0,78 * [ 1,11 (0,7856+ 0,7415) - 0,203 ] = 1,164 A°
Il existe bien un composé stable de formule NCH. Ce composé est nommé acide cyanhydrique et est un gaz extrêmement toxique et mortel même à très faibles doses. La détermination expérimentale de la géométrie de ce composé montre qu’il s’agit d’une molécule linéaire contenant deux liaisons différentes de longueurs respectives : 1,0657 A° et 1,1530 A°.
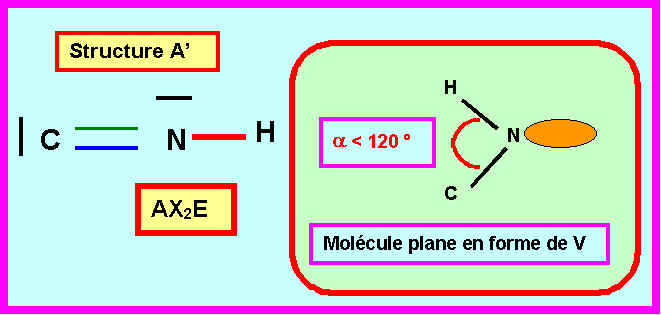
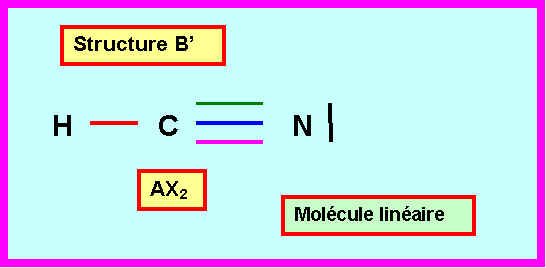
1-4) Quelle structure A’ ou B’ vous semble convenir pour ce composé ?
Attribuer les deux longueurs de liaisons expérimentales.
Seule la structure B’ linéaire peut convenir pour le composé CNH.
L’attribution des longueurs de liaison est la suivante :
Liaison |
Longueur calculée |
Longueur expérimentale |
Ecart % |
H - C |
1,053 A° |
1,0657 A° |
1,2 % |
C - N |
1,164 A° |
1,1530 A° |
0,95 % |
1-5) En déduire la structure de Lewis probable (structure A ou structure B) du radical CN.
La structure du radical CN est donc probablement la structure B.
Le composé hydrogéné CNH est un acide faible (pKa = 9,2).
2) Utilisation du modèle C.L.O.A
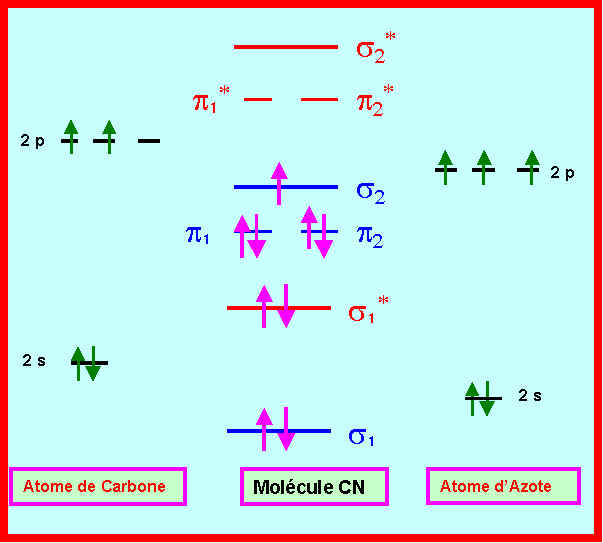
2-1) Donnez un diagramme qualitatif des orbitales moléculaires du composé CN.
On supposera qu’il y a interactions sp.
2-2) Calculer l’indice de liaison.
nl = ( n – n* ) / 2 = ( 7 – 2 ) / 2 = 2,5
2-3) Justifiez la longueur de liaison observée.
Liaison CN :
Simple liaison : ( 1,11 * ( 0,7856 + 0,7415 )) – 0,203 = 1,492 A°
Double liaison : 0,86 * 1,492 = 1,280 A°
Triple liaison : 0,78 * 1,492 = 1,164 A°
Longueur expérimentale : 1,1718 A°.
Intermédiaire entre la double et la triple liaison comme le laisse prévoir l’indice de liaison de 2,5.
2-4) On peut obtenir deux ions différents à partir du composé CN : un anion CN- et un cation CN+.
Classer en justifiant votre réponse ces trois espèces (CN, CN+ et CN-) selon l’ordre croissant de :
Pour obtenir CN- on ajoute un électron liant à CN. L’ion CN- est donc plus stable que CN. L’indice de liaison augmente de 0,5 et passe donc à 3 pour CN-, l’énergie de liaison de CN- sera donc plus élevée que celle de CN et la longueur de liaison sera plus faible dans CN- que dans CN.
Pour obtenir CN+ on enlève un électron liant à CN. L’ion CN+ est donc moins stable que CN. L’indice de liaison diminue de 0,5 et passe donc à 2 pour CN+, l’énergie de liaison de CN+ sera donc plus faible que celle de CN et la longueur de liaison sera plus grande dans CN+ que dans CN.
Soit finalement l’ordre cherché :
Stabilité : CN+ < CN < CN-
Energie de liaison : CN+ < CN < CN-
Longueur de liaison : CN- < CN < CN+