UNIVERSITE DE LA REUNION ANNEE UNIVERSITAIRE 1997-1998
FACULTE DES SCIENCES
SESSION DE SEPTEMBRE 98
DEUXIEME PERIODE
Formulaire - Rappels - Données :
On rappelle la formule permettant le calcul approché du rayon de covalence d’un atome: R(A°) = 0,215 n2/Z* + 0,148 n + 0,225
Z*O = 4,55 Z*S = 5,45 (Pour H on prendra la valeur RH = 0,346 A°)
On rappelle la formule permettant le calcul approché des longueurs de liaisons.
L(A°) = 1,11 Lcalc - 0,203 (Lcalc = longueur calculée par addition des rayons de covalence)
Double liaison = 86 % de la simple - Triple liaison = 78 % de la simple
On rappelle la formule empirique de Hanney-Smith permettant le calcul du pourcentage ionique d’une liaison à partir de l’écart d’électronégativité Dx :
%ion = 16 (Dx )+ 3,5 (Dx)2
Echelle d’électronégativité de Pauling : (DX)2 = EAB - Ö ( EAA * EBB )
Energies de liaisons en k J mol-1 :
EH-H = 436 ; ES-H = 368 ; ES-S = 266 ; EO-H = 463 ; EO-O = 143
1 D = 3,33 10-30 C.m 1 F = 96500 C e = 1,6 10-19 C 1A° = 10-10 m
H2S est un diacide faible pK1 = 7 et pK2 = 13
Exercice 1 : Composés Hydrogénés de l’Oxygène et du Soufre
1) Quels sont les composés hydrogénés prévisibles pour ces deux éléments ?
2) Donner une structure de Lewis des molécules correspondantes.
3) Quelle est la géométrie prévisible de ces molécules. On fera un dessin représentant les molécules dans l’espace et on précisera les angles prévus théoriquement.
4) Les données expérimentales concernant ces molécules sont les suivantes :
ATTENTION : LES VALEURS SONT DONNEES DANS LE DESORDRE
Longueur de Liaison : 0,96 A° et 1,35 A°
Angles HXH : 92 ° et 105 °
Moments Dipolaires des molécules : 0,95 D et 1,85 D
a) Comment varie l’électronégativité dans la classification périodique ?
Entre S et O quel est l’élément le plus électronégatif ?
b) Déterminer quantitativement les électronégativités de O et S dans l’échelle de Pauling. On prendra comme référence XH = 2,2.
c) Compte tenu des électronégativités différentes de O et S et de la présence éventuelle de doublets libres comment vont être modifié les angles HXH ?
Attribuer à chaque molécule la valeur réelle de cet angle.
d) Pour les liaisons O - H et S - H . Calculer en utilisant les formules rappelées plus haut :
* Le pourcentage ionique des liaisons.
* Le moment dipolaire de liaison.
Exercice 2 :
Pour les molécules ou ions suivants : ICl3 - N2F4 - HCN - PO43-
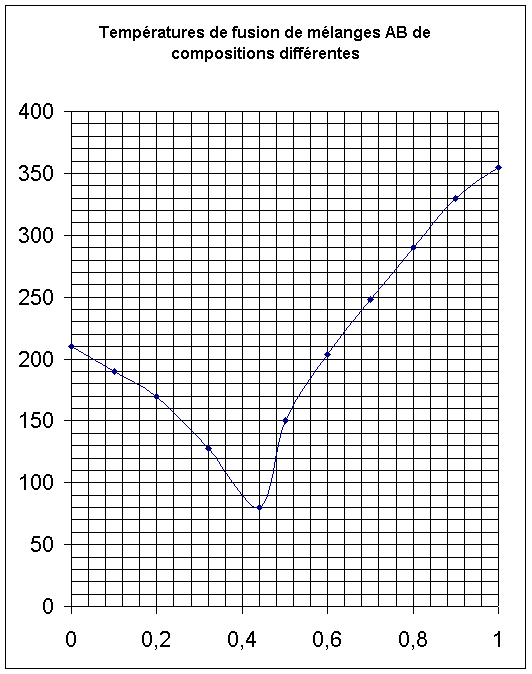
Exercice 1 : Mélanges binaires
On étudie la solidification de mélanges liquides AB de compositions différentes. On obtient les résultats suivants :
| xA | 0 |
0,1 |
0,2 |
0,322 |
0,44 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
1 |
| Tsolid | 210 |
190 |
170 |
128 |
80 |
150 |
204 |
248 |
290 |
330 |
355 |
Et on trace le graphique correspondant :

xA : fraction molaire de A dans le mélange
Tsolid : Température de solidification du mélange liquide

Exercice 2 : (R = 8,314 J mol-1 K-1 = 0,082 l atm mol-1 K-1)
Dans un réacteur de 10 litres on introduit une certaine quantité d'oxyde de fer Fe3O4 et 1 mole de monoxyde de carbone CO. On porte ensuite à la température de 1000K. Il se produit la réaction équilibrée : Fe3O4 (s) + CO (g) = 3 FeO (s) + CO2 (g)
La constante de cet équilibre est K = 1,1 à cette température.
Calculer les pressions partielles de chaque gaz à l'équilibre.
b) Si la quantité de Fe3O4 introduite est de 100g (soit 0,43 mole).
Exercice 3 :
Le point de fusion du peroxyde d'hydrogène H2O2 est de -1,7 °C.
Sa chaleur latente de fusion DfusH0 est de 10 Kj mol-1.
Calculer son entropie standard de fusion DfusS0.