SUJET DE CHIMIE THEORIQUE-ATOMISTIQUE
SESSION DE SEPTEMBRE 99 – Deuxième période
LES MOLECULES
LE DIAZOMETHANE
DONNEES :
On rappelle la formule empirique permettant le calcul approché des longueurs de liaisons (en A°) à partir des rayons de covalence calculés des atomes :
Liaison simple : LAB = 1,11 (RA + RB ) - 0,203
Liaison double : 86% de la simple
Liaison triple : 78% de la simple
On donne les rayons de covalence calculés pour C, N et H :
RC = 0,7856 A° - RN = 0,7415 A° - RH = 0,346 A°
Le diazométhane CH2N2 est un composé gazeux très instable (explosif) et très toxique. Il est néanmoins très utilisé en chimie organique pour sa très grande réactivité.
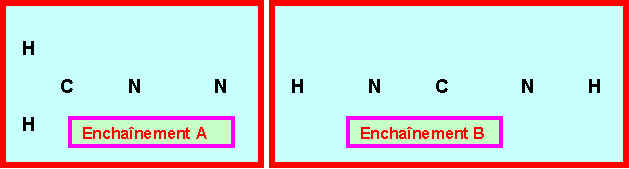
On peut envisager deux enchaînements différents pour cette molécule :

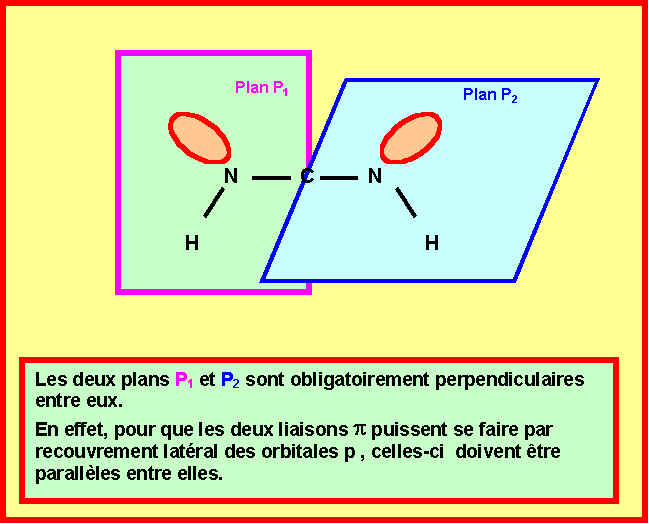
ON SUPPOSERA DANS UN PREMIER TEMPS QUE L'ATOME DE CARBONE NE PORTE PAS DE CHARGES FORMELLES.
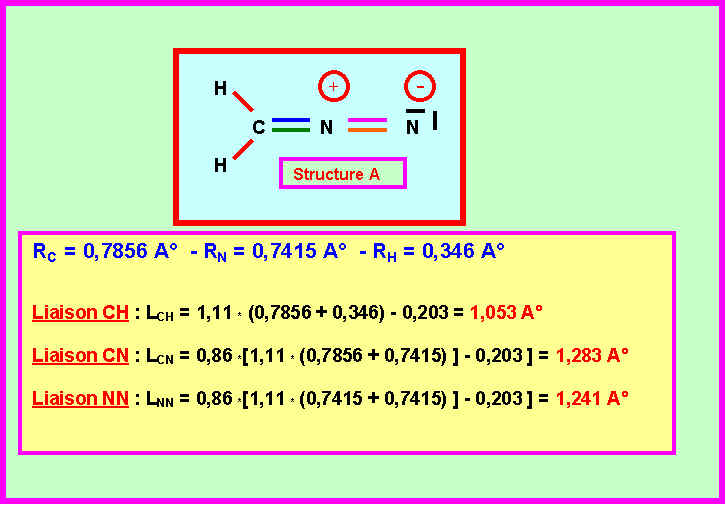
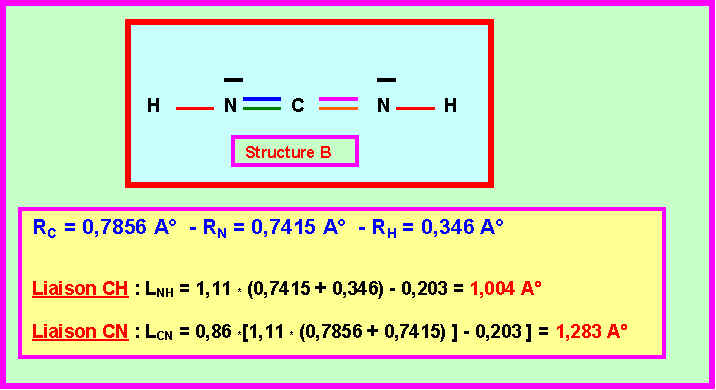
Les données expérimentales concernant cette molécule montrent qu’elle est constituée par l’enchaînement de trois types de liaisons de longueurs respectives :
1,08 A°– 1,32 A°– 1,12 A°
3-1) montrer qu'un seul des enchaînements A et B peut correspondre à ces données expérimentales. Lequel ?
Seul l'enchaînement A qui présente trois type de liaisons CH, CN et NN peut convenir.
( L'enchaînement B symétrique et qui ne présente que deux types de liaisons NH et CN ne peut convenir. )
3-2) Attribuer les longueurs de liaisons expérimentales et complétez le tableau suivant :
Liaison |
Calculée |
Expérimentale |
Ecart % |
CH |
1,053 |
1,08 |
2,5 % |
NN |
1,241 |
1,12 |
-10,8 % |
CN |
1,283 |
1,32 |
2,8 % |
Nota : Ecart % = 100 *( Lcalc - Lexp ) / Lexp
3-3) Pour deux de ces liaisons l'accord entre valeur calculée et valeur expérimentale est assez bon. Lesquelles ?
Les longueurs des liaisons CH et CN semblent assez correctement évaluées.
3-4) Pour une de ces liaisons l'accord entre valeur calculée et valeur expérimentale est assez mauvais. Laquelle ?
La longueur de la liaison NN est sensiblement plus courte que la valeur calculée.
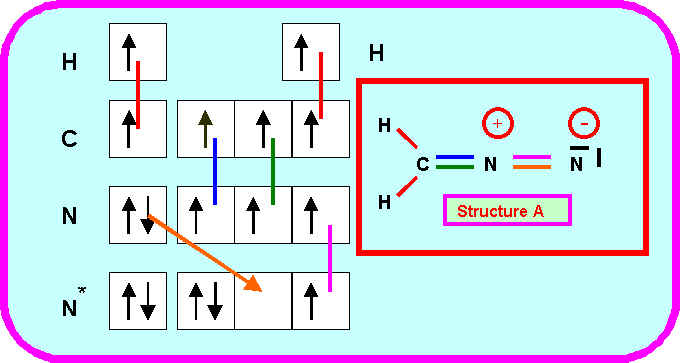
3-5) Intervention de formes mésomères :
Montrer qu'on peut écrire deux autres formes mésomères dans lesquelles l'atome de Carbone porte une charge négative.
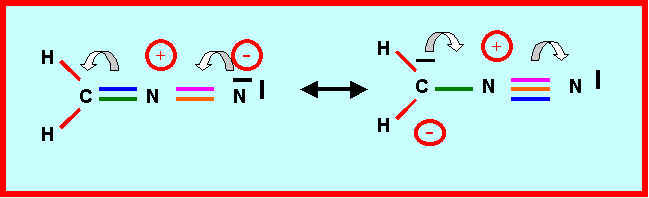
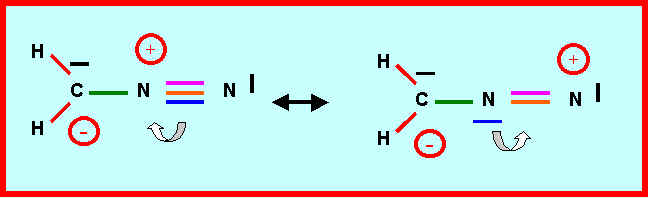
3-6) Montrer comment l'intervention de ces formes mésomères permet d'expliquer qu'une des liaison est sensiblement raccourcie (laquelle ?) et une autre légèrement allongée (laquelle ?).
La liaison double CN devient simple et s'allonge donc.
Simple liaison LCN = 1,11 * ( 0,7856 + 0,7415) - 0,203 = 1,492 A°
Cette liaison sera donc en réalité intermédiaire entre la simple (1,49 A°) et la double (1,28 A°).
La liaison double NN devient triple et est donc raccourcie.
Triple liaison LCN = 0,78 * [ 1,11 * (0,7415 + 0,7415) ] - 0,203 ] = 1,126 A°
L'attribution des longueurs de liaisons expérimentales est donc la suivante :
Liaison CN : 1,32 A° (1,28 < 1,32 < 1,49) (Plus proche de la double liaison que de la simple)
Liaison NN : 1,12 A° (pratiquement triple)
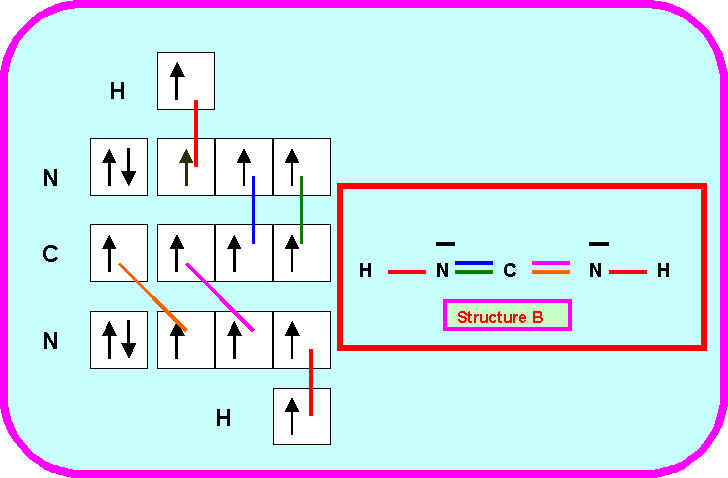
4) Pour l’enchaînement B ( H N C N H ) :
4-1) Prévoir la géométrie de la molécule à l’aide de la méthode V.S.E.P.R.
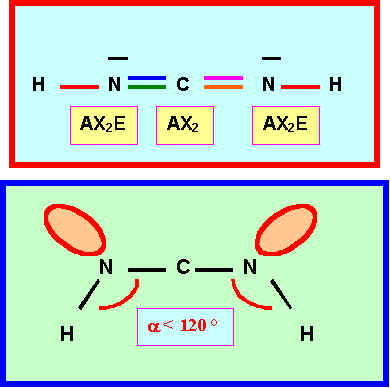
4-2) En déduire l'hybridation des atomes de Carbone et d'Azote dans cette structure B.
* C : Hybridation sp pour géométrie linéaire AX2
* N : Hybridation sp2 pour géométrie trigonale AX2E
4-3) Décrire par un schéma la formation des liaisons dans cette structure B.
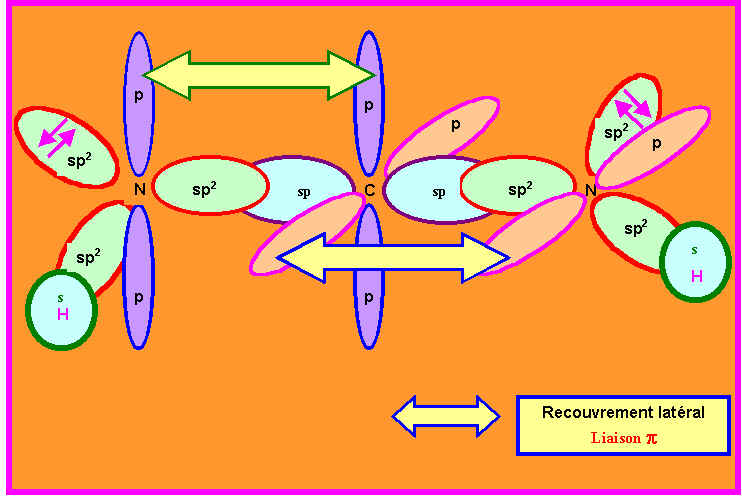
4-4 ) Montrer que l'on peut déduire du schéma précédant une information supplémentaire sur la géométrie de cet édifice qui ne pouvait être prévue par la méthode V.S.E.P.R