S.M. 1 - Session de Septembre 2001- Rattrapage 2ème période
" Initiation à la Chimie Théorique - Les molécules "
CORRIGE
DONNEES :
Numéros atomiques :
H : ( Z = 1 ) - C : ( Z = 6 ) - O : ( Z = 8 ) - Cl : ( Z = 17 ) - As ( Z = 33 ) - Br : ( Z = 85)
Electronégativités dans l'échelle de Pauling :
As ( X = 2,2 ) - Br : ( X = 2,96 ) - Cl ( X = 3,16 ) - O : ( X = 3,44 )
Moments dipolaires des liaisons
As - Cl : m = 1,6 D - As - Br : m = 1,3 D ( 1 D = 0,333 10-29 C.m )
Exercice 1 :
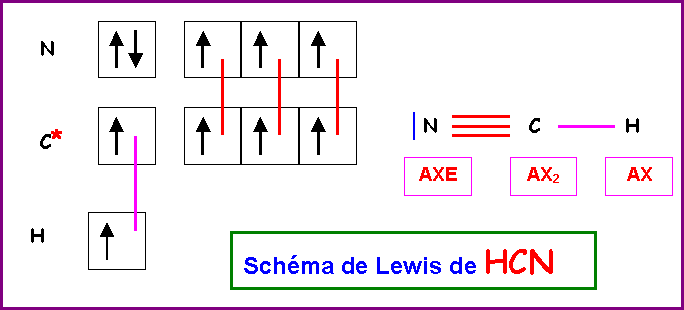
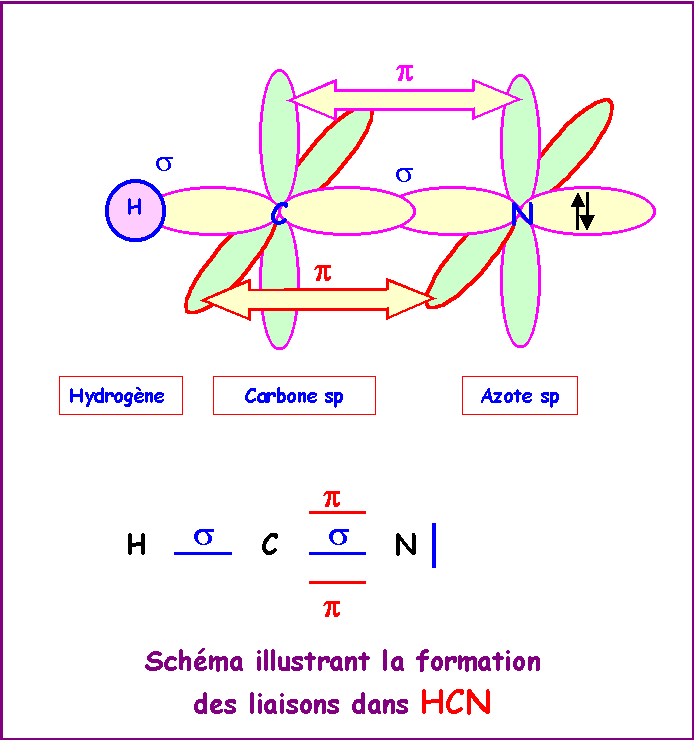
Décrire la géométrie, l'hybridation et la formation des liaisons pour la molécule d'acide cyanhydrique HCN.

Atome de Carbone :
La géométrie autour de l'atome de Carbone central est du type AX2 .
La molécule est donc linéaire.
L'hybridation de l'atome de Carbone convenant pour décrire cette géométrie linéaire est l'hybridation de type sp.
Atome d'Azote :
Autour de l'Azote on a une géométrie du type AXE donc linéaire également.
L'hybridation de l'atome d'Azote convenant pour décrire cette géométrie linéaire est l'hybridation de type sp.
Exercice 2 : Composés de l'Arsenic
Ion arsénite : AsO33- - Ion arséniate : AsO43-
Donner le schéma de Lewis et une représentation spatiale de ces deux ions.
As : Z = 33 - (Ar) 3d10 4s2 4p3
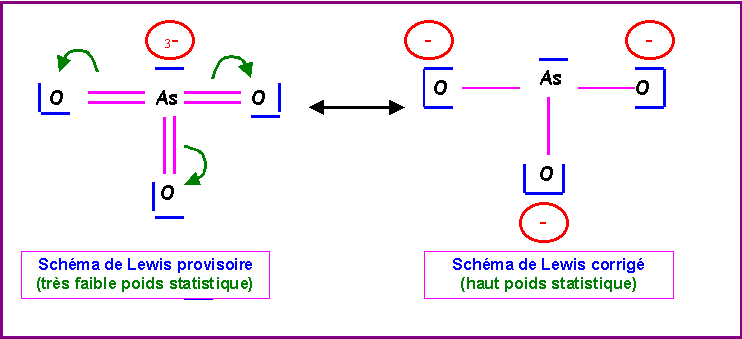
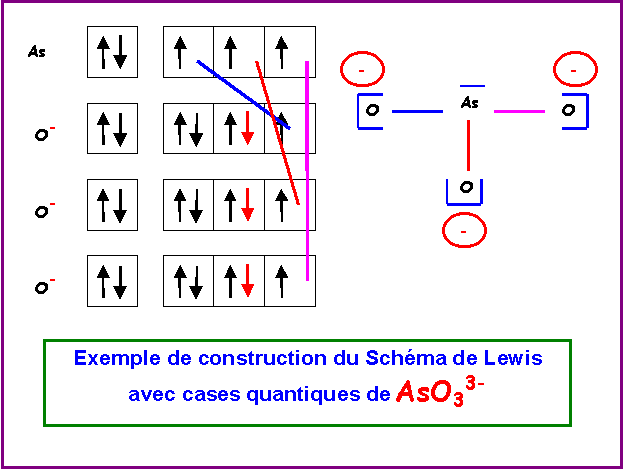
Ion arsénite : AsO33-
"Méthode rapide"
L'Arsenic étant l'atome central se voit attribué les 5 électrons de sa couche de valence et les 3 électrons supplémentaires correspondant à la charge de l'ion.
L'Oxygène atome latéral est supposé faire des doubles liaisons puisqu'il possède deux électrons célibataires sur sa couche de valence.
L'Arsenic possède donc 8 électrons et en utilise 6 pour faire les trois doubles liaisons avec les atomes d'Oxygène. Il lui reste donc deux électrons non utilisés soit un doublet libre. Cela permet d'écrire un schéma de Lewis provisoire dans lequel l'atome d'Arsenic porte trois charges négatives. Cet excès de charges sur le même atome doit être corrigé pour obtenir une structure mésomère de plus haut poids statistique, il suffit pour cela de rabattre les doublets des doubles liaisons vers les atomes d'Oxygène. On obtient ainsi le schéma de Lewis corrigé pour lequel ce sont les atomes d'Oxygène qui portent les charges négatives ce qui est en accord avec l'électronégativité de cet atome qui est supérieure à celle de l'Arsenic.
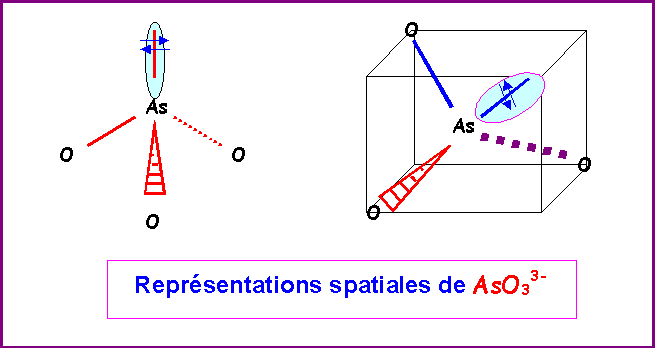
La géométrie moléculaire est du type AX3E, pyramide à base triangulaire soit en fait un tétraèdre amputé d'un sommet, les angles OAsO seront proches de 109,5°.
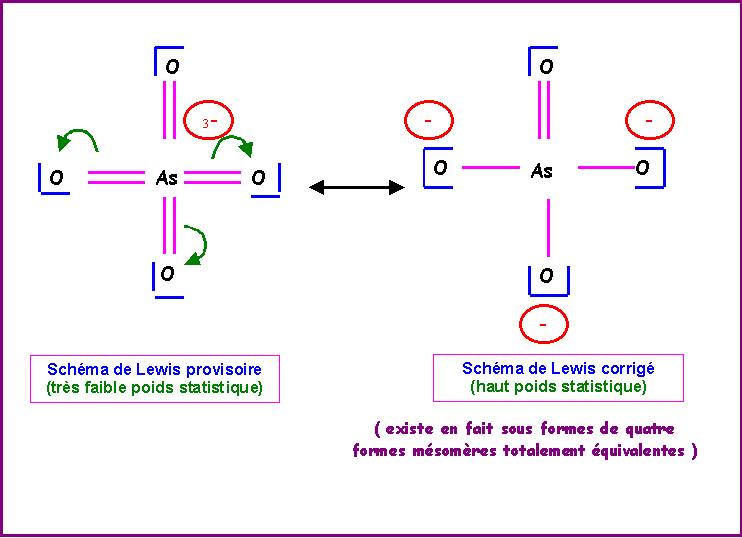
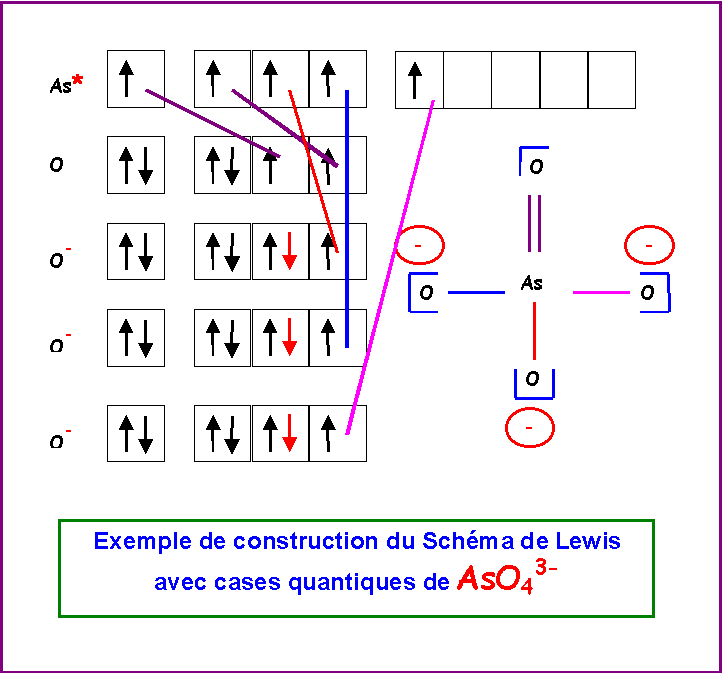
Ion arséniate : AsO43-
"Méthode rapide"
L'Arsenic étant l'atome central se voit attribué les 5 électrons de sa couche de valence et les 3 électrons supplémentaires correspondant à la charge de l'ion.
L'Oxygène atome latéral est supposé faire des doubles liaisons puisqu'il possède deux électrons célibataires sur sa couche de valence.
L'Arsenic possède donc 8 électrons et en utilise 8 pour faire les quatre doubles liaisons avec les atomes d'Oxygène. Il ne lui reste donc pas d'électrons non utilisés soit aucun doublet libre. Cela permet d'écrire un schéma de Lewis provisoire dans lequel l'atome d'Arsenic porte trois charges négatives. Cet excès de charges sur le même atome doit être corrigé pour obtenir une structure mésomère de plus haut poids statistique, il suffit pour cela de rabattre les doublets des doubles liaisons vers les atomes d'Oxygène. On obtient ainsi le schéma de Lewis corrigé pour lequel ce sont les atomes d'Oxygène qui portent les charges négatives ce qui est en accord avec l'électronégativité de cet atome qui est supérieure à celle de l'Arsenic. Il existe en fait quatre formes mésomères totalement équivalentes en échangeant simplement les rôles des Oxygènes.
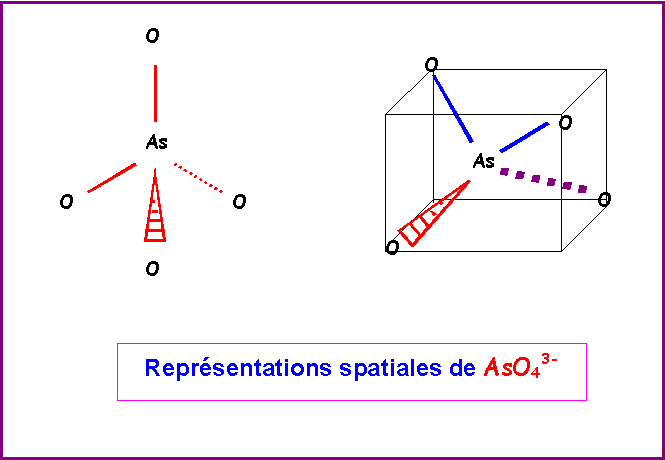
La géométrie moléculaire est du type AX4, soit un tétraèdre parfait en raison de la symétrie totale de la molécule, les angles OAsO seront exactement de 109,5°.
2) AsBr2Cl3
Soit le composé de formule AsBr2Cl3
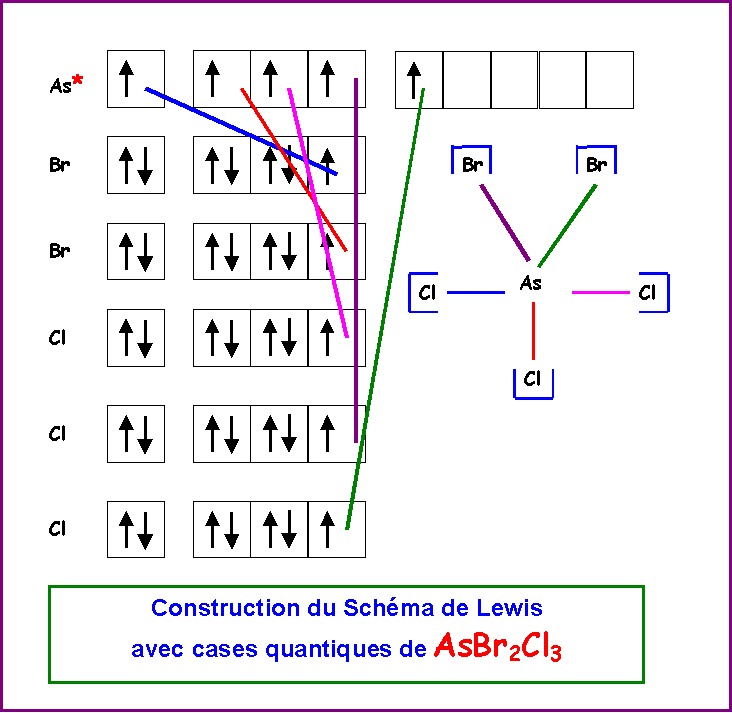
La géométrie autour de As est du type AX5 soit une bi-pyramide à base triangle, les sommets ne sont pas équivalents, il existe trois sommets équatoriaux et deux sommets axiaux.
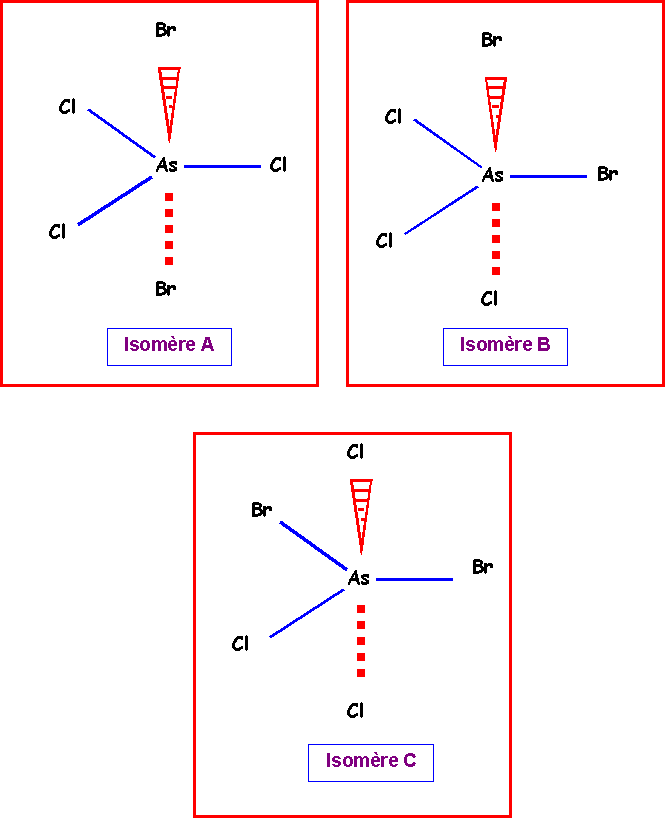
On pourra donc placer les atomes latéraux de trois manières différentes :
Isomère A :
2 Bromes axiaux et 3 chlores équatoriaux.
Isomère B :
1 Brome axial, 1 Brome équatorial, 1 chlore équatorial et 2 chlores axiaux.
Isomère C :
2 Bromes équatoriaux , 2 Chlores axiaux et 1 Chlore équatorial.
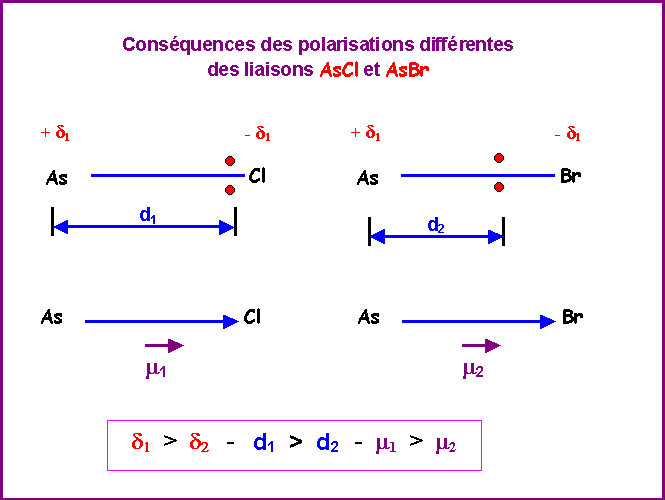
Electronégativités dans l'échelle de Pauling :
As ( X = 2,2 ) - Br : ( X = 2,96 ) - Cl ( X = 3,16 )
Liaison As - Br :
Br plus électronégatif que As attire les électrons de la liaison vers lui, la liaison AsBr est donc polarisée.
Liaison As - Cl :
Cl plus électronégatif que As attire les électrons de la liaison vers lui, la liaison AsCl est donc polarisée.
Le Chlore étant plus électronégatif que le Brome la polarisation des liaisons AsCl est plus importante que celle des liaisons AsBr.
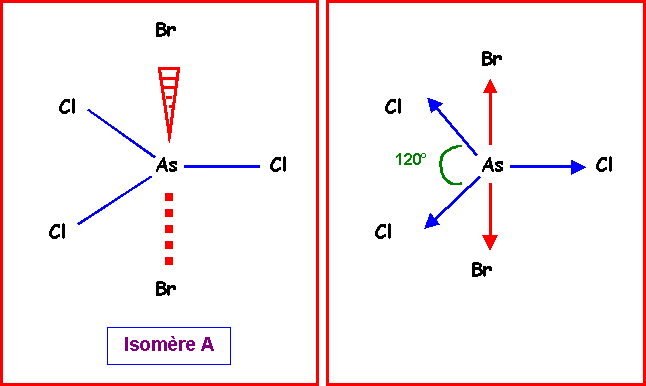
Conséquences :
L'existence de ces dissymétries va se répercuter sur les stabilités relatives des trois isomères. L'isomère le plus stable sera celui pour lequel les répulsions entre doublets seront minimales, c'est à dire celui pour qui les doublets seront le plus éloignés de l'atome central. L'atome le moins électronégatif (ici Br) se placera donc préférentiellement en positions équatoriales (angles de 120°) plutôt qu'en positions axiales (angles de 90° uniquement).
L'ordre de stabilité croissante est donc :
Isomère A < isomère B < isomère C
( 2 Br axiaux) < (1 Br équatorial) < (2 Br équatoriaux )
Remarque :
Les atomes peu électronégatifs attirant peu les électrons sont de gros atomes
Les atomes très électronégatifs attirant fortement les électrons sont de petits atomes.
Le raisonnement plus simple (mais moins rigoureux) consistant à se baser sur la taille de l'atome en disant que les gros atomes se placent préférentiellement en position équatoriale car ils y trouvent plus de place (encombrement stérique) conduit donc au même résultat qualitatif.
Isomère A :
On voit facilement sur la représentation spatiale que les deux vecteurs correspondant aux moments dipolaires des liaisons AsBr s'annulent mutuellement.
De plus, la résultante de deux vecteurs mAsCl donne un vecteur opposé au troisième. Les trois vecteurs mAsCl s'annulent donc les uns les autres et leur résultante est nulle.
On peut le vérifier par le calcul :
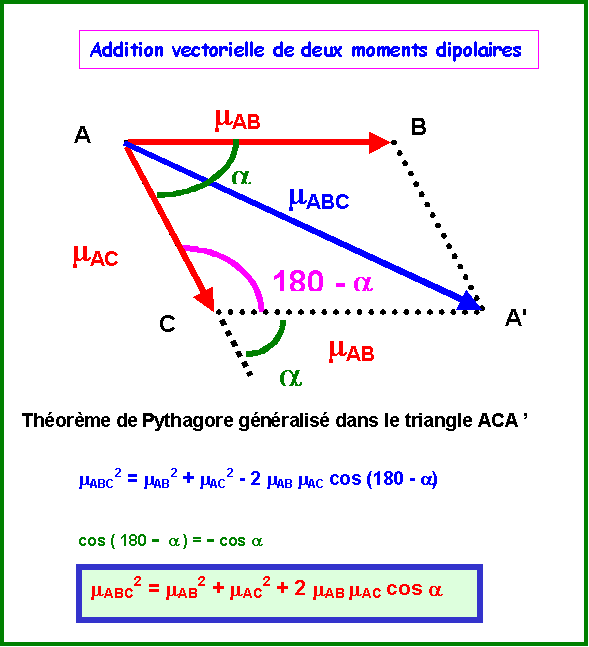
Dans le cas qui nous intéresse :
mAB = mAC = mAsCl et a = 120°
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = mAsCl2 + mAsCl2 + 2 mAsCl mAsCl cos 120
mABC2 = 2 mAsCl2 ( 1 + cos 120 )
mABC2 = 2 mAsCl2 ( 1 - 0,5 )
mABC2 = mAsCl2
mABC = mAsCl
La somme des deux vecteurs mAsCl équatoriaux donne bien un vecteur opposé au troisième.
Finalement le moment dipolaire global de l'isomère A est donc nul.
Isomère B :
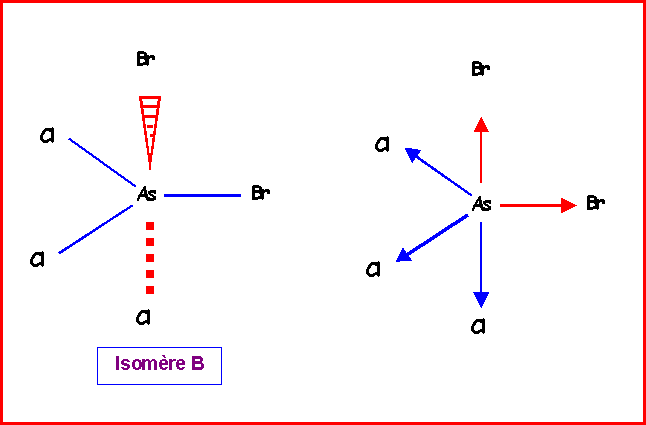
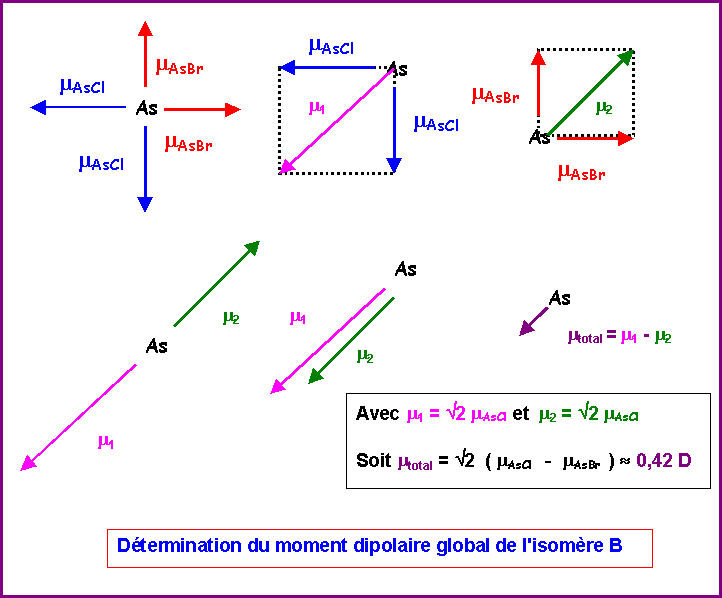
Nous venons de voir qu'on pouvait remplacer les deux vecteurs mAsCl équatoriaux par un seul de sens opposé au vecteur mAsBr équatorial. On peut ensuite additionner les deux vecteurs mAsBr orthogonaux entre eux et les deux vecteurs mAsBr orthogonaux entre eux également.
Soit :
mAB = mAC = mAsCl et a = 90°
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = mAsCl2 + mAsCl2 + 2 mAsCl mAsCl cos 90
mABC2 = 2 mAsCl2
mABC = Ö 2 mAsCl
De même pour les vecteurs mAsBr
mABC = Ö 2 mAsBr
Il suffit ensuite d'additionner les deux résultantes partielles (qui sont de sens opposé) pour obtenir le moment dipolaire global de l'isomère B.
m = Ö 2 ( mAsCl - mAsBr ) = Ö 2 ( 1,6 - 1,3 ) » 0,42 D
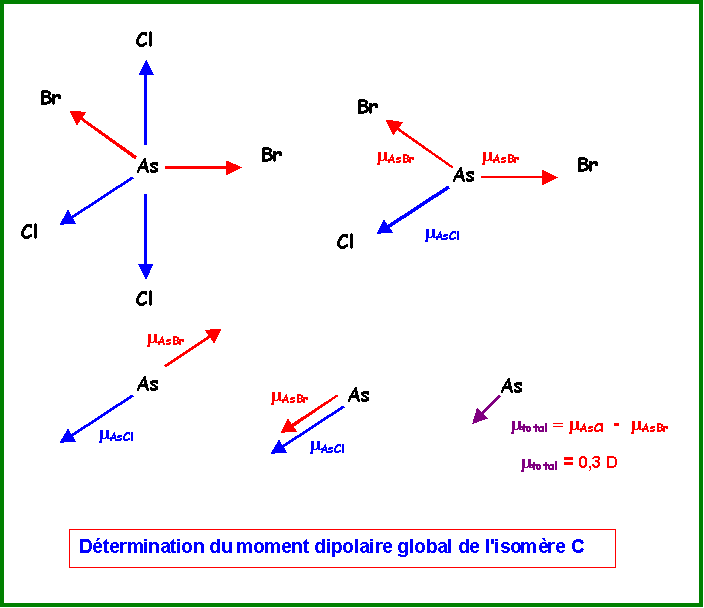
Isomère C :
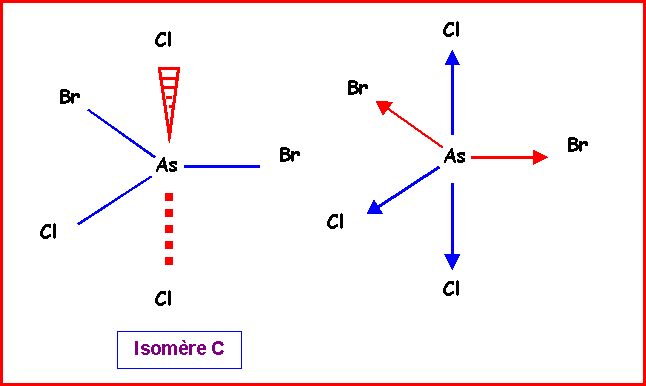
Ce cas est beaucoup plus simple que le précédant.
Les deux vecteurs mAsCl axiaux s'annulent mutuellement.
On remplace les deux vecteurs mAsBr équatoriaux par un seul de sens opposé au vecteur mAscl équatorial.
La résultante est donc mtotal = mAsCl - mAsBr = 1,6 - 1,3 = 0,3 D
Résumé :
Isomère |
Moment dipolaire global (en Debye) |
A |
0 |
B |
0,42 |
C |
0,3 |