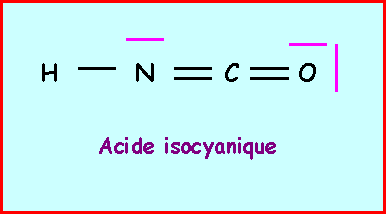
PREMIERE SERIE DE T.D
Structures de Lewis des molécules - Mésomérie
Prévision des géométries moléculaires par la méthode V.S.E.P.R
L’atome dont le symbole est souligné est l’atome central
Les rayons de covalence des atomes seront évalués par la formule
R (A°) = 0,215 (n*2/Z*) + 0,148 n* + 0,225
(avec n*=n pour n=1 ou n=2 ; n*=3.6 pour n=4 et n*=4 pour n=5
Pour H on prendra RH = 0,346 A°
Les longueurs de liaisons (en A°) seront évaluées par la formule
dA-B = 1,11 dCalc - 0,203
(dCalc = somme des rayons de covalence en A°)
ou plus simplement, sans passer par l’intermédiaire des rayons de covalence
L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
Liaison double = 86 % de la simple - Liaison triple = 78% de la simple
Exercice 1 :
Soient les atomes de la colonne 15 de la classification périodique : X l'élément de la deuxième et Y l'élément de la troisième période:
- donner le nom et le symbole de ces atomes X et Y
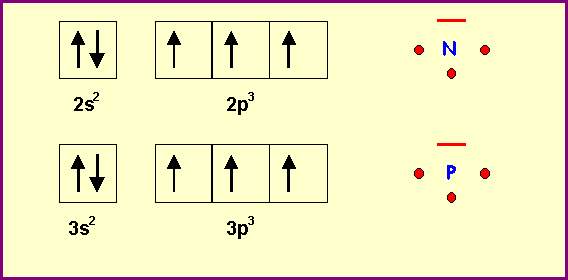
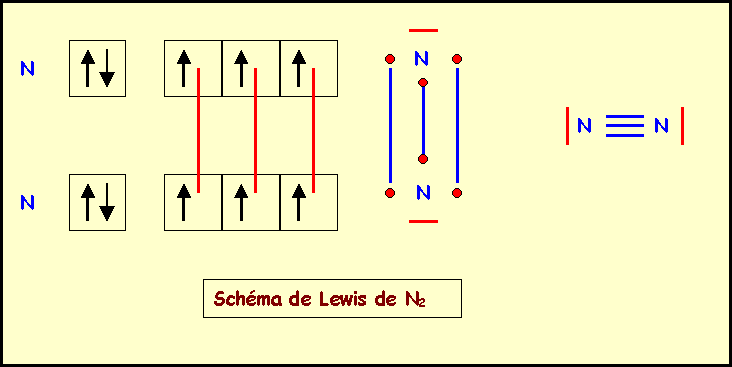
X est l'azote N - Y est le phosphore P
- écrire leur schéma de Lewis atomique.
N
: Z = 7 : 1s2 2s2 2p3 : (He) 2s2 2p3P
: Z = 15 : 1s2 2s2 2p6 3s2 3p3 : (Ne) 3s2 3p3 
- la formule de l'élément X est du type X2. Justifier en établissant son schéma de Lewis moléculaire.
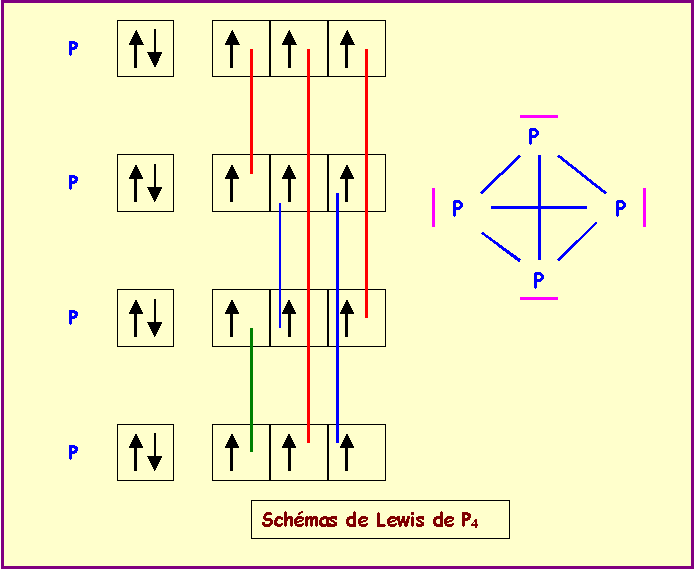
- Pour l'élément Y, il existe aussi un composé de formule Y2 mais il existe également un composé de formule Y4, justifier en établissant son schéma de Lewis moléculaire, sachant que chaque atome Y est relié au trois autres.
- prévoir les formules des composés hydrogénés de ces deux éléments.
N et P ont une valence normale de 3 (3 électrons célibataires)
H à une valence de 1 (1 électron célibataire)
Les formules des dérivés hydrogénés seront donc: NH3 et PH3
- Ces deux éléments donnent avec l'atome d'oxygène des ions de formules XO3- et YO3-. Etablir leur schéma de Lewis moléculaire.
O : Z =8 :
(He) 2s2 2p4 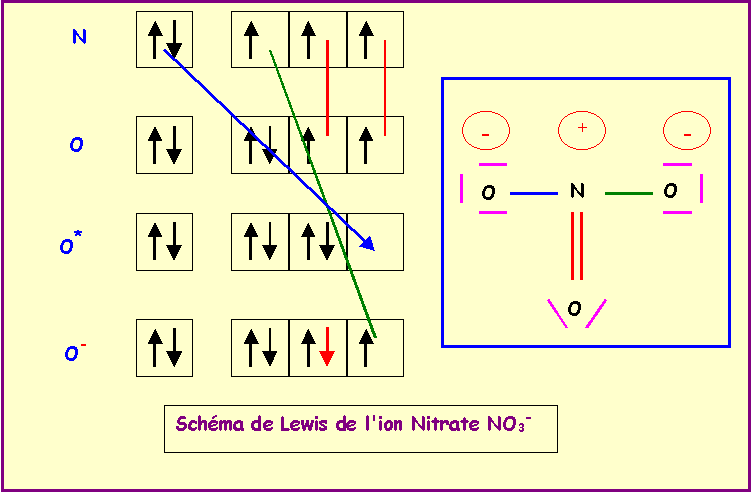
Méthode rapide :
N central : 5 électrons + 1 électron (charge moins) : 6 électrons
O latéral : 2 électrons célibataires = double liaison
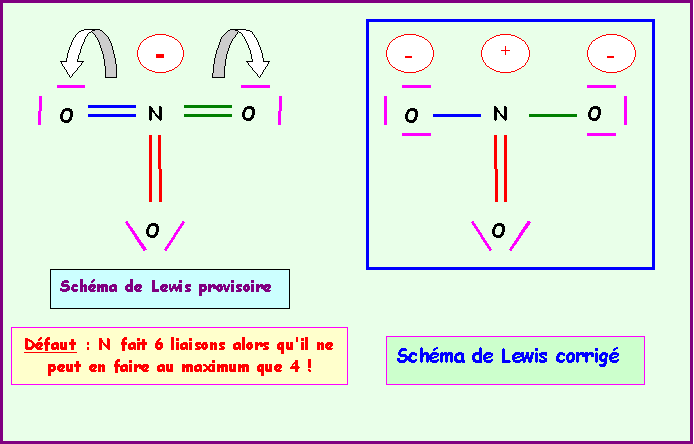
L'azote fait donc 6 liaisons avec O et ne possède donc pas de doublet libres.
On obtient le schéma de Lewis provisoire qu'il faut ensuite corriger en déplaçant deux doublets vers O supprimant ainsi 2 liaisons sur N qui élément de la deuxième période ne peut faire au maximum que 4 liaisons.
PO3-
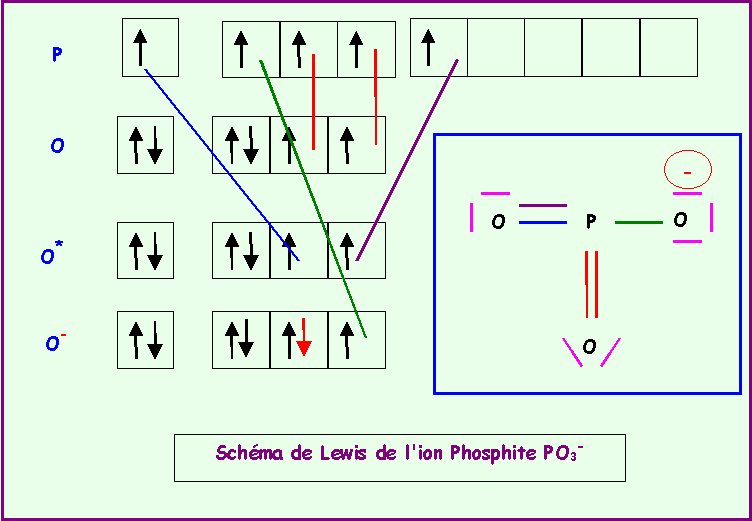
Méthode rapide :
P central : 5 électrons + 1 électron (charge moins) : 6 électrons
O latéral : 2 électrons célibataires = double liaison
Le Phosphore fait donc 6 liaisons avec O et ne possède donc pas de doublet libres.
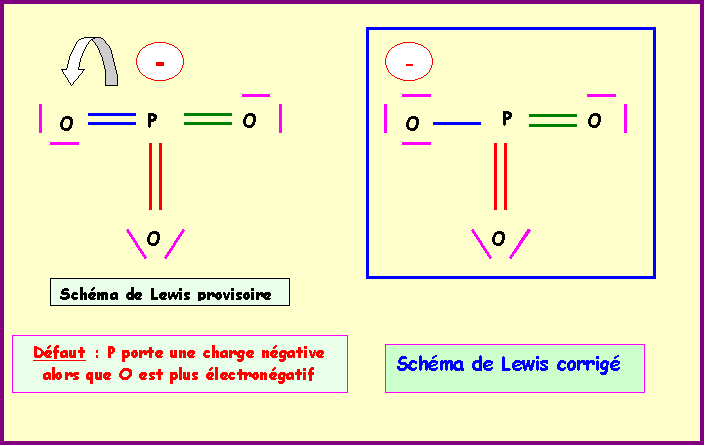
On obtient le schéma de Lewis provisoire qu'il faut ensuite corriger en déplaçant un doublet vers O pour déplacer la charge négative vers O.
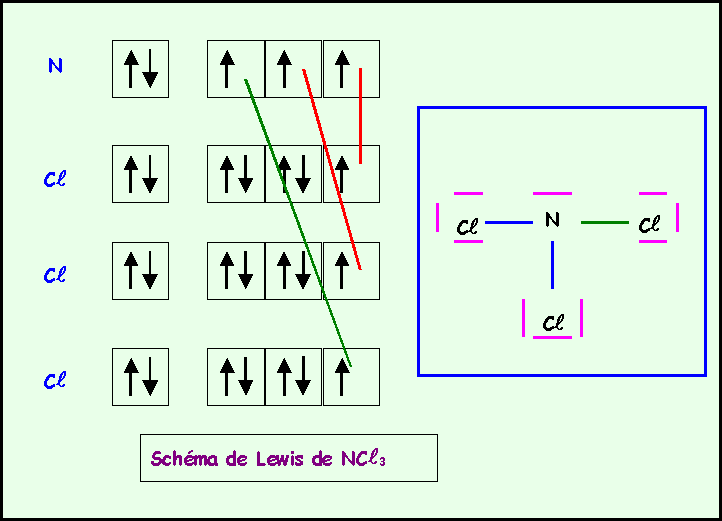
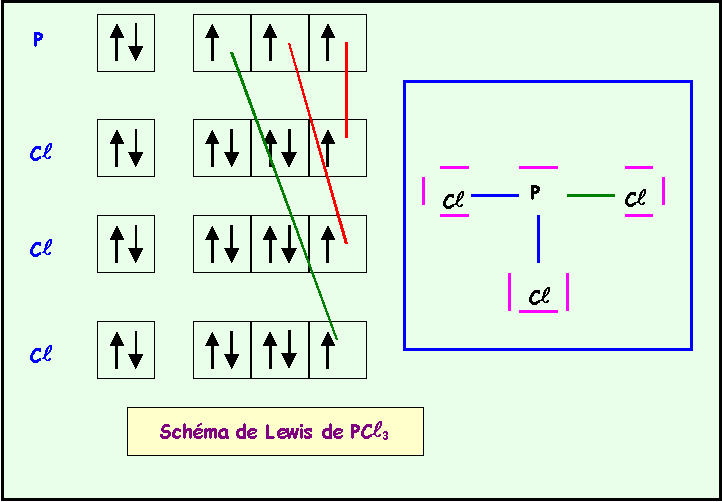
NC
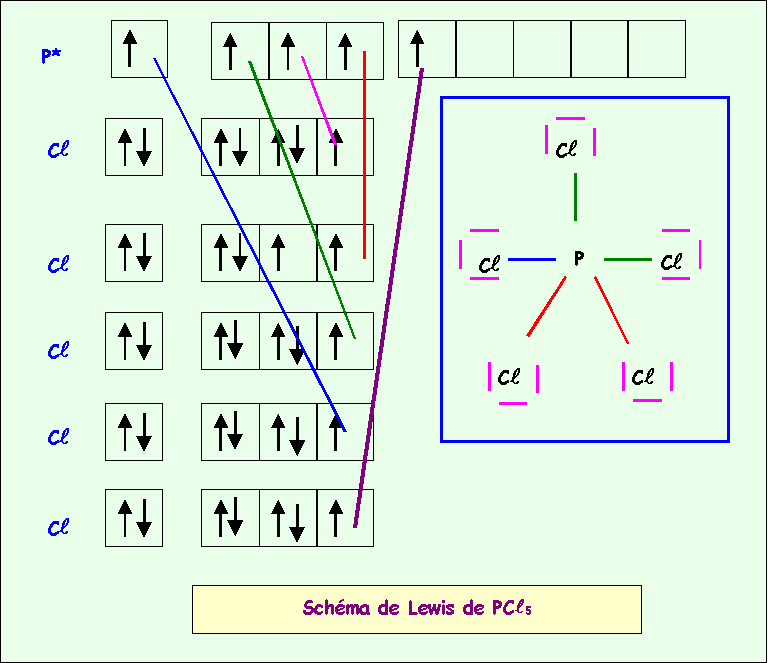
l5 ne peut exister car N élément de la deuxième période ne possède pas de niveau d et ne peut donc faire que 4 liaisons au maximum. P est lui excitable grâce au niveau 3d et peut donc avoir la valence 5.
Exercice 2
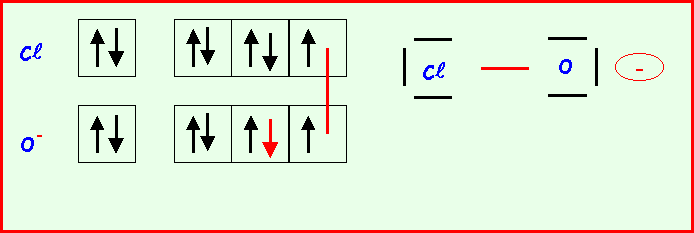
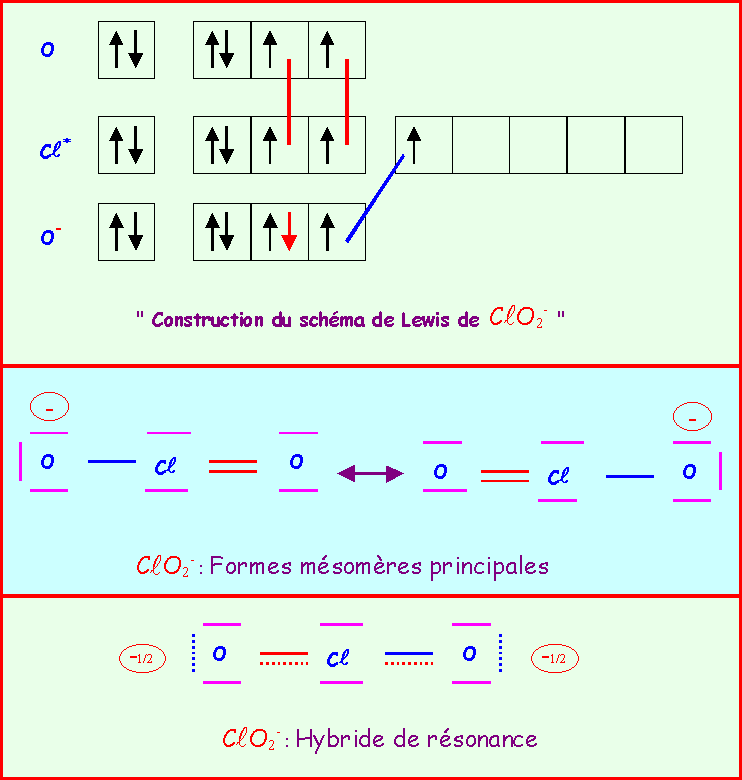
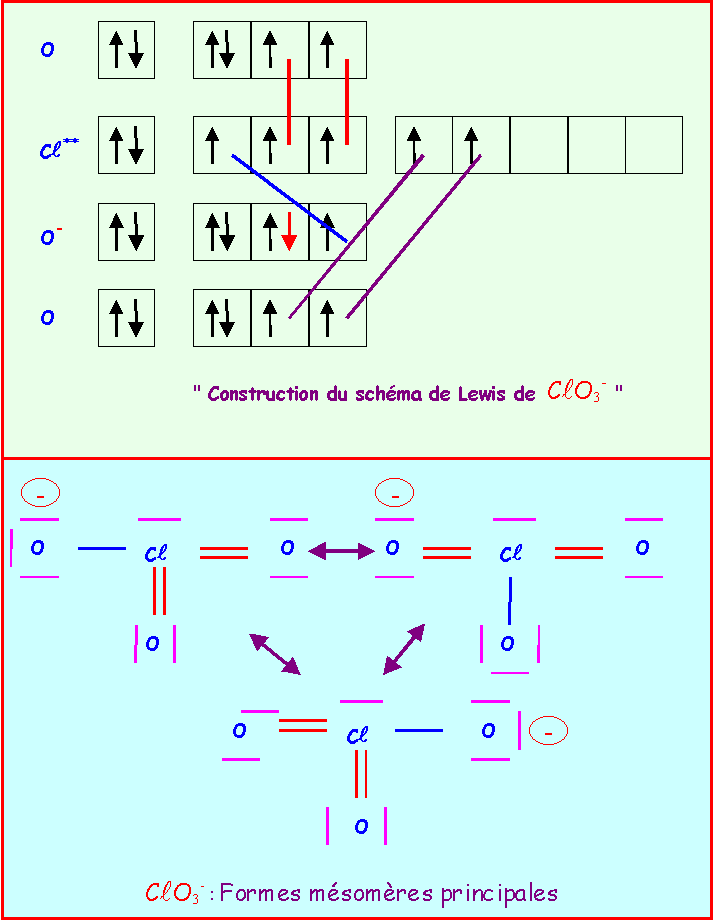
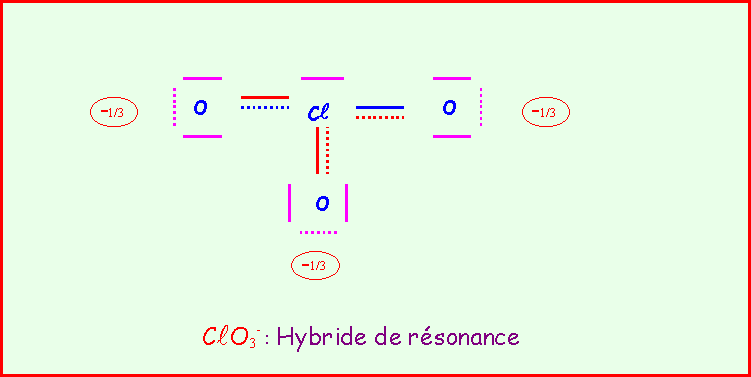
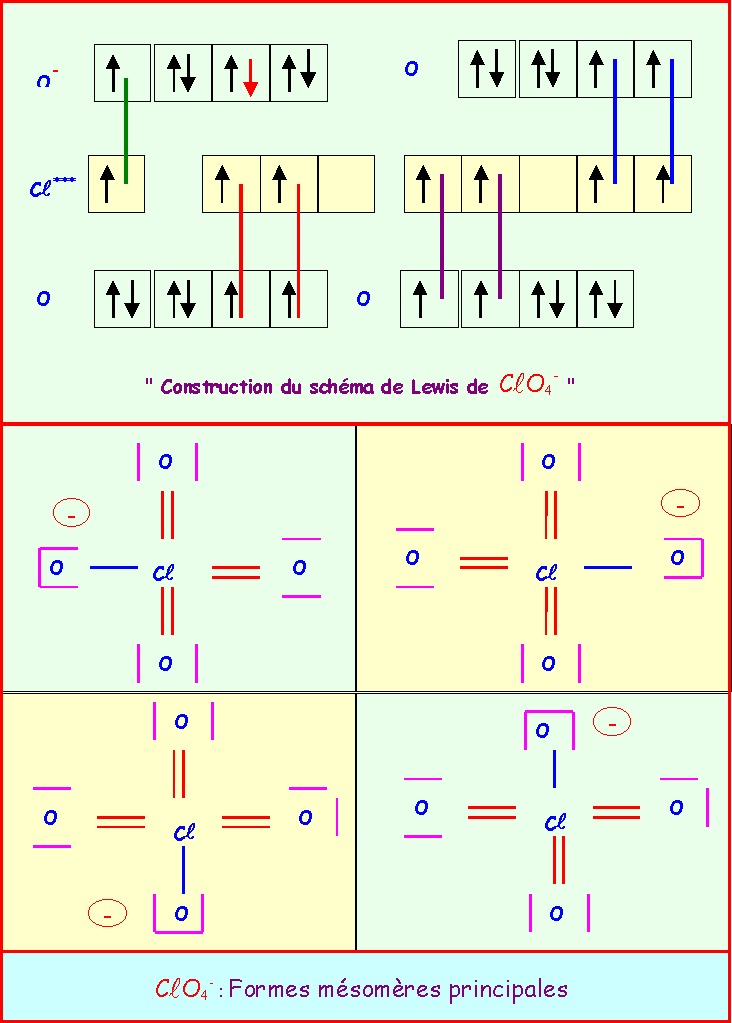
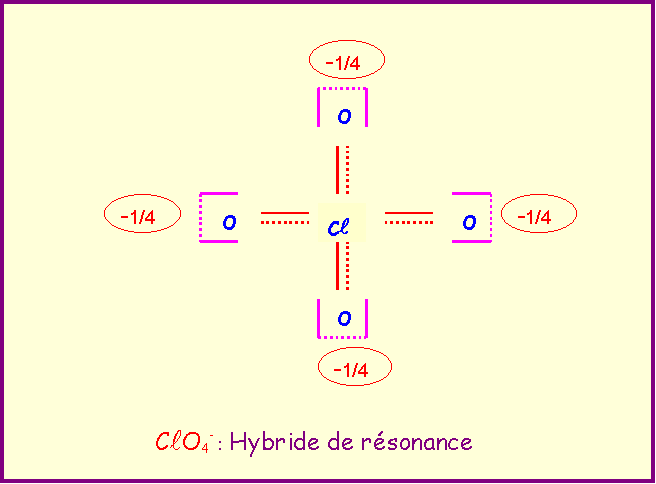
Le chlore donne avec l'oxygène des ions de formules : ClO-, ClO2-, ClO3-, ClO4-
Pour chacun établir le schéma de Lewis moléculaire correspondant, écrire les formes mésomères principales, et décrire par un schéma l'hybride de résonance correspondant à la molécule réelle.
On suppose que O est légèrement plus électronégatif que Cl (échelle de Pauling).
Exercice 3
:Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
AlCl3 ; SO2 ; PO43- ; CO32- ; H3 O+ , NO2- ; NO2+ , XeF4 , XeO3
Exercice 2
:Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
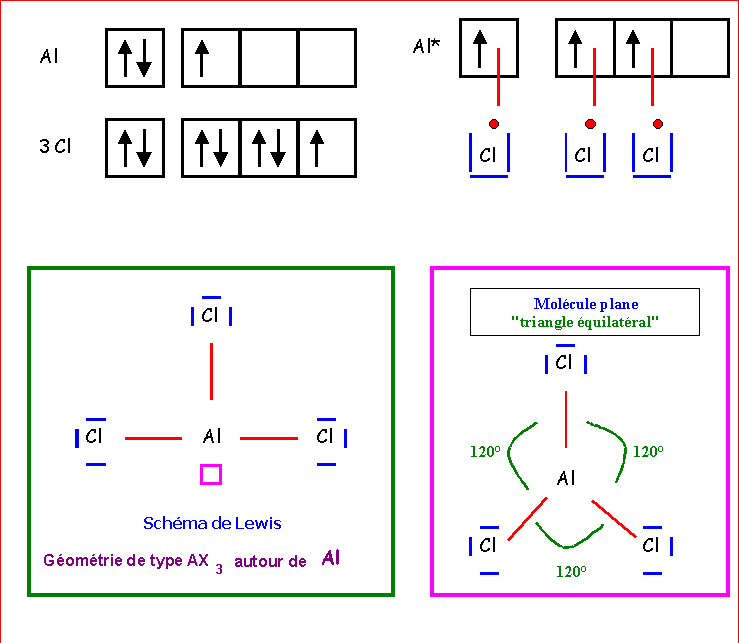
Al
Cl3 ; SO2 ; PO43- ; CO32- ; H3O+ , NO2- ; NO2+ , XeF4 , XeO3Al
Cl3
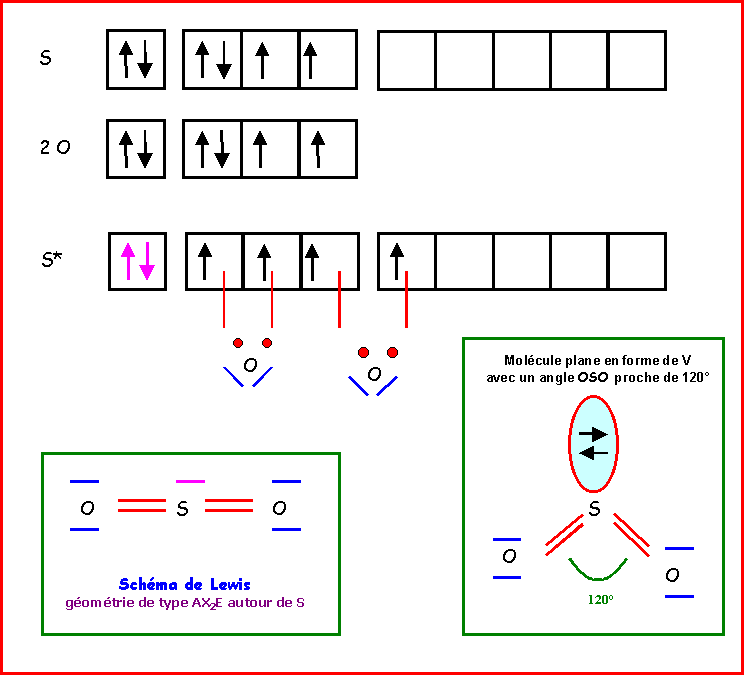
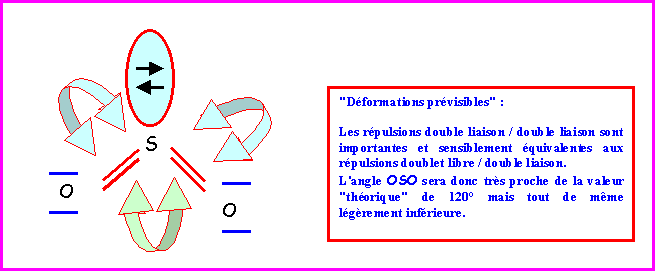
SO2
P
O43-Nous allons utiliser la "méthode rapide".
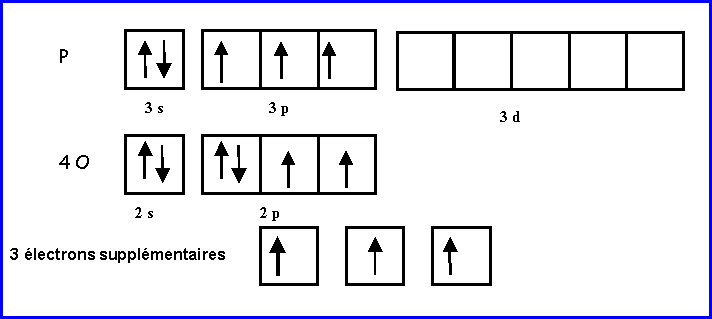
Les atomes latéraux O sont supposés faire des doubles liaisons puisqu'ils possèdent 2 électrons célibataires.
L'atome central P possède 5 électrons et on lui attribue de plus les 3 électrons supplémentaires soit 8 électrons au total.
Il utilise ses 8 électrons pour faire 4 doubles liaisons avec les 4 atomes d'oxygène et ne possédera donc pas de doublets libres.
Sur cette base on peut facilement déduire un schéma de Lewis provisoire.
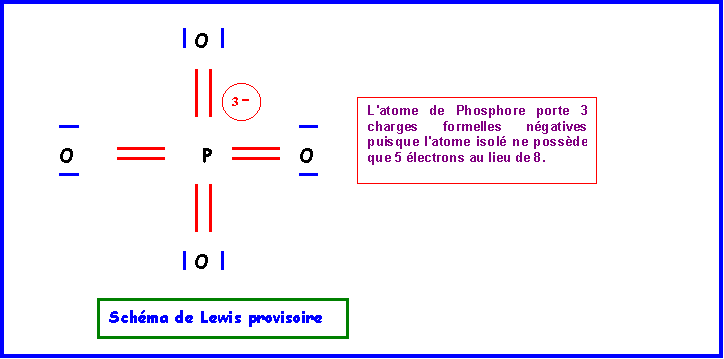
Cette première structure ne présenta pas d'impossibilités puisque qu'avec ses 9 cases quantiques ( 3s , 3p, 3d ) il peut théoriquement former jusqu'à 9 liaisons. Néanmoins cette forme possède deux grands défauts qu'il convient de corriger :
- 3 charges sur un même atome
- électronégativité non respectée puisque O est plus électronégatif que P.
Echelle de Pauling : X
O = 3,44 - XP = 2,12Le remède consiste à "rabattre" les doublets vers l'atome d'oxygène.
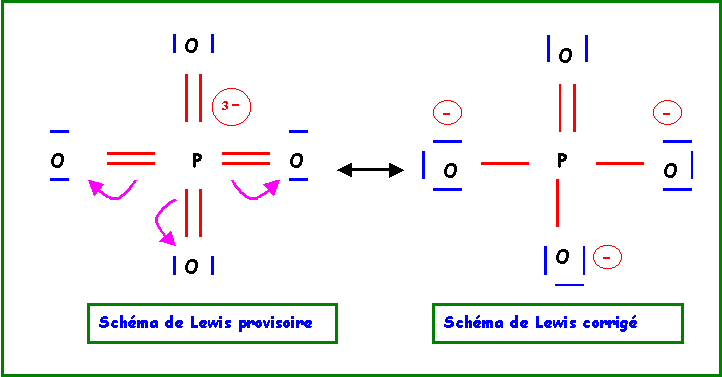
Cette forme mésomère de haut poids statistique existe en fait sous 4 formes totalement équivalentes en permutant les rôles des quatre atomes d'Oxygène. La molécule réelle sera un hybride de résonance entre ses 4 formes.
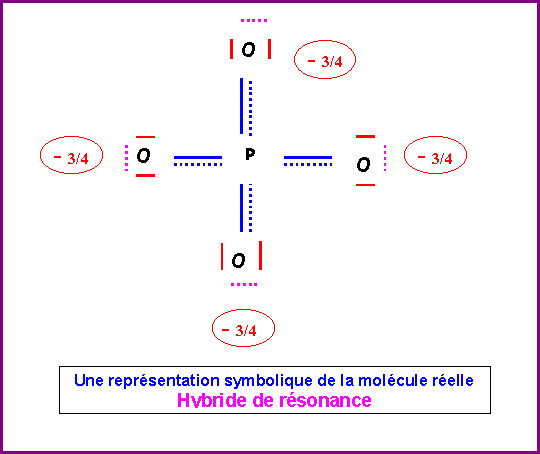
La molécules réelle est parfaitement symétrique avec une géométrie de type AX4 autour de l'atome de Phosphore central.
La molécule est donc de forme tétraédrique avec des angles
OPO de 109,5°.
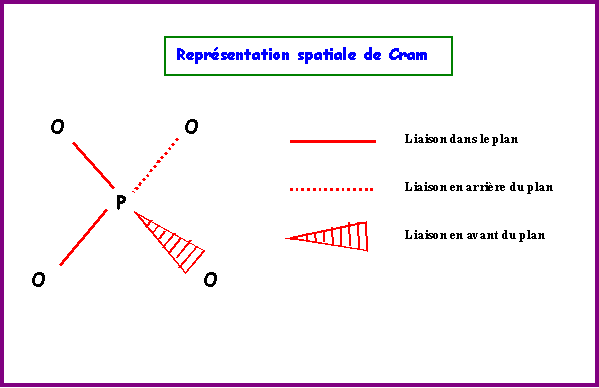
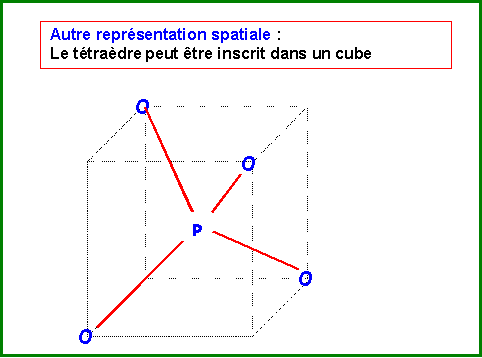
CO32-
Méthode rapide :
C central : 4 électrons + 2 électrons de charge = 6 électrons
3 O latéraux * 2 électrons célibataires => 3 doubles liaisons => 6 liaisons pour C
6 électrons et 6 liaisons => C ne possède pas de doublets libres.
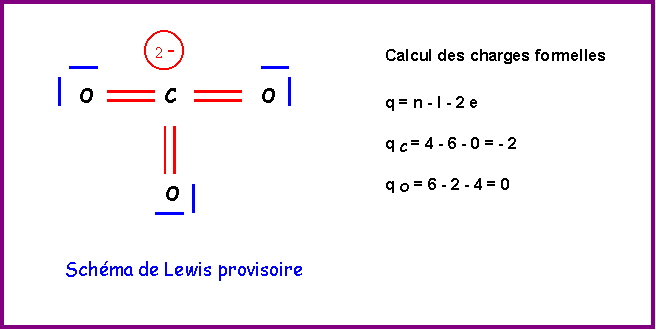
Ce schéma provisoire présente plusieurs gros défauts :
- C élément de la deuxième période présente 6 liaisons ce qui est impossible
- 2 charges sont présentes sur un même atome.
- L'électronégativité n'est pas respectée (XO > XC)
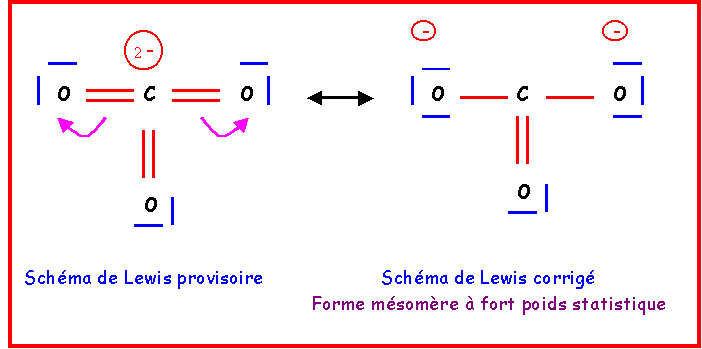
Pour le corriger, il suffira de "rabattre" les doublets vers les atomes d'Oxygène.
Cette forme existe en réalité sous trois formes mésomères totalement équivalentes en échangeant simplement le rôle des oxygènes.
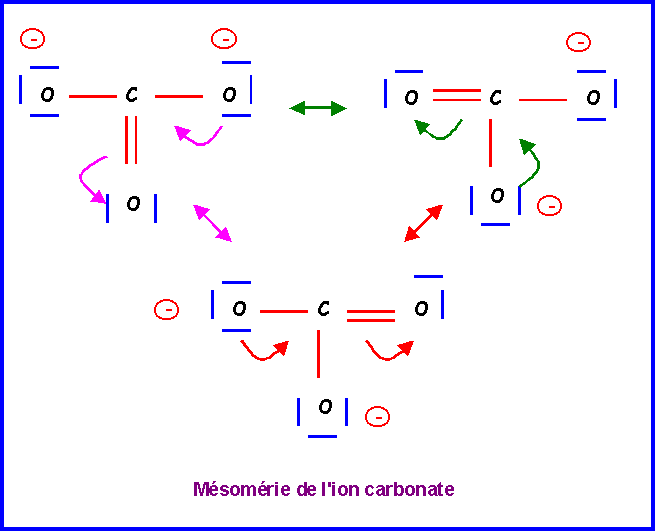
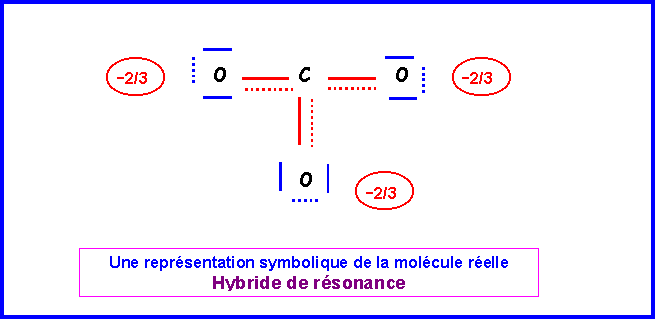
La molécules est du type AX3 avec une symétrie parfaite. Triangle équilatéral plan avec des angles de 120 ° exactement. Les trois liaisons sont identiques et intermédiaires entre la simple et la double liaison.
Exercice 2
: (deuxième partie)H3O+ ; NO2- ; NO2+ ; XeO3 ; XeF4
H3O+
Méthode rapide
:O
central : 6 électrons.On enlève 1 électron a cause de la charge positive soit 5 électrons.
H
latéral possède 1 électron célibataire et fait donc 1 liaison simple avec O.O
central fait donc 3 liaisons avec les 3 H et il lui reste donc 5 - 3 = 2 électrons soit 1 doublet libre. On obtient alors le schéma de Lewis provisoire suivant : 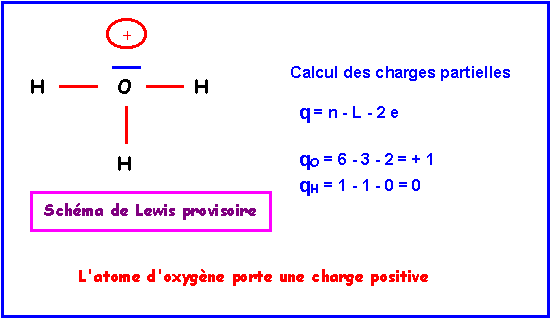
Cette forme provisoire présente le défaut apparent de faire porter une charge positive sur l'atome le plus électronégatif. Il n'est pas possible de le corriger en déplaçant un doublet de liaison de H vers O car la liaison covalente serait brisée pour donner
H2O et H+. En effet, H ne possède pas de doublet libre qui pourrait se déplacer simultanément pour compenser.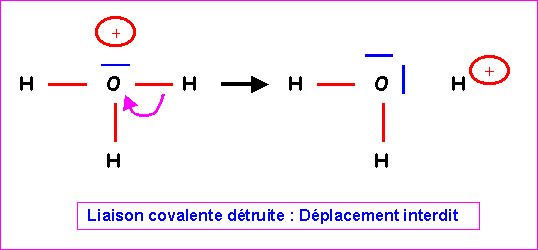
Finalement le schéma de Lewis obtenu est donc le bon.
La géométrie autour de l'atome central est du type AX3E.
On aura donc affaire à un tétraèdre auquel il manquera un sommet. Soit finalement à une structure pyramidale à base triangulaire avec des angles
HOH proches de 109°.En raison des répulsions doublet libre / doublet de liaison ( E / X ) plus importante que les répulsions doublet de liaison / doublet de liaison ( X / X ) l'angle
HOH sera en réalité légèrement inférieur a 109°.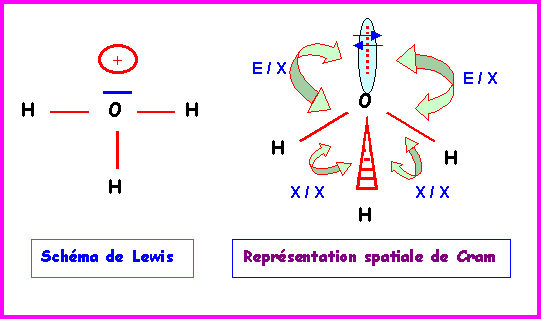
N
O2-Nous allons ici pour changer utiliser la technique des cases quantiques.
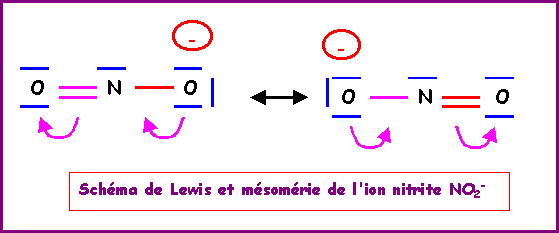
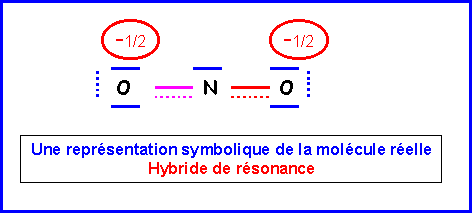
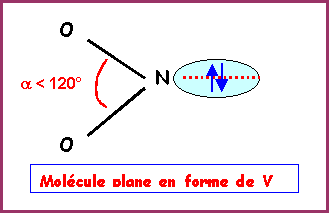
La molécule présente une géométrie de type AX2E autour de l'atome d'azote central.
On aura donc affaire à un triangle équilatéral amputé d'un sommet soit une molécule en forme de V avec un angle ONO légèrement inférieur à 120° a cause des répulsions "doublet libre / doublet de liaison" plus importantes que les répulsions "doublet de liaison / doublet de liaison".
N
O2+Nous allons ici aussi utiliser la technique des cases quantiques.
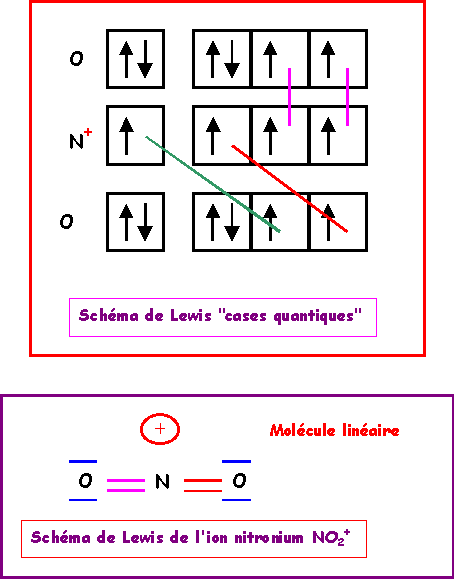
La molécule présente une géométrie de type AX2 autour de l'atome d'azote central soit une molécule linéaire.
XeO3
Méthode rapide
:L'atome central Xe possède 8 électrons de valence.
L'atome latéral O possède 2 électrons célibataire et forme donc une double liaison.
Xe forme donc 6 liaisons avec les 3 O et il lui reste donc 8 - 6 = 2 électrons soit 1 doublet libre.
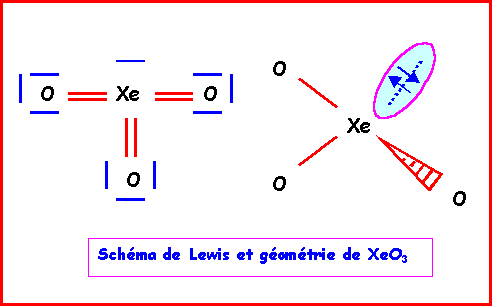
Comme pour
H3O+, la géométrie est du type AX3E autour de l'atome central.On a donc affaire à un tétraèdre amputé d'un sommet.
Les angles
OXeO sont légèrement inférieur à 109°, la molécule est en forme de pyramide à base triangulaire.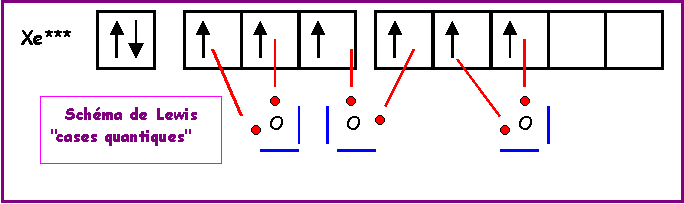
Remarque
: Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc que très difficilement des composés chimiques stables, et ce n'est qu'en 1962 qu'on réussit à synthétiser de tels composés. C'est la grande réactivité de l'Oxygène et notamment sa forte électronégativité qui expliquent que XeO3 existe. Les liaisons sont formées en utilisant les cases 5 d vides du Xénon.
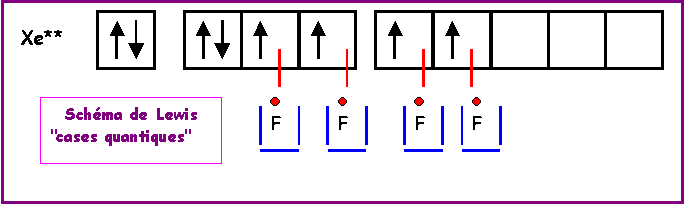
XeF4
Méthode rapide
:L'atome central Xe possède 8 électrons de valence.
L'atome latéral F possède 1 électron célibataire et forme donc une simple liaison.
Xe forme donc 4 liaisons avec les 4 F et il lui reste donc 8 - 4 = 4 électrons soit 2 doublets libres.
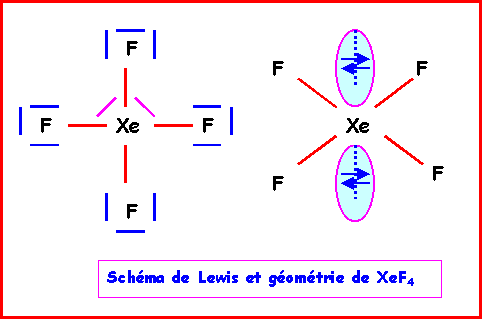
La géométrie est du type AX4E2 autour de l'atome central.
On a donc affaire à un octaèdre amputé de 2 sommets.
Comme les répulsions doublet libre doublet libre sont les plus importantes, les 2 doublets libres se placent à l'opposé l'un de l'autre et la molécule a la forme d'un carré. Les angles
FXeF sont tous de 90°, la molécule est plane.Remarque : Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc que très difficilement des composés chimiques stables, et ce n'est qu'en 1962 qu'on réussit à synthétiser de tels composés. C'est la grande réactivité du Fluor et notamment sa forte électronégativité qui expliquent que XeF4 existe. Les liaisons sont formées en utilisant les cases 5 d vides du Xénon.
Exercice 4 :
Une formule empirique permet de calculer à priori l’ordre de grandeur des pKa des acides oxygénés : pKa = 8 - 5n + 9z
n est le nombre d’atome d’oxygène non hydroxylés.
z est la charge globale (en valeur absolue) éventuelle de l’acide.
Par exemple l’acide sulfurique H2SO4 a la structure de Lewis (incomplète) suivante :
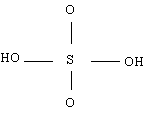
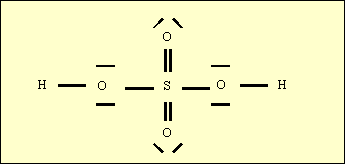
2) Cette structure de Lewis fait apparaître deux oxygènes non hydroxylés (O) et deux oxygènes hydroxylés (OH). La charge globale de l’acide est nulle.
Le pKa calculé par la formule empirique est donc : pKa = 8 -(2*5) + (9*0) = - 2
2-a) Que peut on conclure de cette valeur négative ?
La première acidité de H2SO4 est forte, dans l'eau H2SO4 se dissocie totalement en HSO4- et H3O+
2-b) Calculer la deuxième constante d’acidité de H2SO4 (couple HSO4-/SO42-)
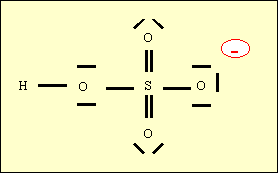
Cette structure de Lewis fait apparaître trois oxygènes non hydroxylés (O) et un oxygène hydroxylé (OH). La charge globale de l’acide est de -1.
Le pKa calculé par la formule empirique est donc : pKa = 8 -(3*5) + (9*1) = 2
La valeur trouvée dans les tables est de pK2 = 1,92.
3) Pour l’ion sulfate SO42-
3-a) : Montrer que plusieurs formes mésomères sont possibles.
S possédant un niveau d accessibles peut "théoriquement" faire jusqu'à 9 liaisons puisqu'il possède 9 cases quantiques disponibles (1 case s + 3 cases p + 5 cases d).
On peut donc envisager avec 4 atomes d'Oxygène : (A) 4 doubles liaisons - (B) 3 double et 1 simple - (C) 2 doubles et 2 simples - (D) 4 simples. De plus la position relative des doubles liaisons peut être différentes ce qui peut conduire à plusieurs formes mésomères différentes dans chaque cas.
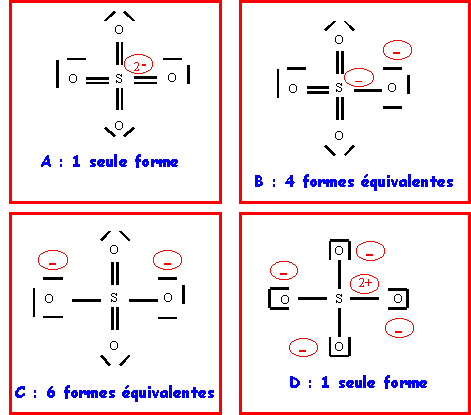
3-b) : Parmi ces diverses formes préciser quelle est celle qui représente le mieux cet ion moléculaire. Justifiez simplement la réponse.
La forme C est la forme de plus haut poids statistique car elle présente la meilleure répartition des charges puisque O est plus électronégatif que S.
3-c) : Donner une représentation de l’ion moléculaire réel.
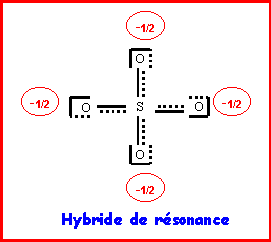
3-d) : Pour l’ion moléculaire réel prévoir la géométrie.
On précisera les valeurs attendues pour les angles OSO, ainsi que les valeurs prévues pour la longueur des liaisons S-O.
Les quatre liaisons sont identiques, la molécule est parfaitement symétrique et du type AX4, les angles OSO seront parfaitement tétraédriques de valeur 109,5°.
La liaison est intermédiaire entre simple et double liaison.
O : 1s2 2s2 2p4
Z*O = 8 - (5 * 0,35 ) - 2 = 4,25 et nO = 2
S : 1s2 2s2 2p6 3s2 3p4
Z*S = 16 - ( 5 * 0,35 ) - ( 8 * 0,85 ) - 2 = 5,45 et nS = 3
L (A°) = 0,239
S (n*2/Z*) + 0,164 S n* + 0,297L (A°) = 0,239
( 4/4,25 + 9/5,45 )+ 0,164 ( 2 + 3 ) + 0,297 = 1,737 A°Double liaison : 0,86 * 1,737 = 1,493
1,493 A° < l < 1,737 A°
4) Il existe plusieurs acides oxygénés du phosphore :
Acide phosphinique (hypophosphoreux) de formule brute H3PO2
Acide phosphonique ( phosphoreux) de formule brute H3PO3
Acide orthophosphorique de formule brute H3PO4
On donne les règles suivantes :
- Le phosphore est toujours l’atome central.
- Les atomes d’oxygène sont toujours directement liés à lui.
- Les atomes d’hydrogène peuvent être liés soit au phosphore (liaison P-H) soit à l’oxygène (liaison O-H).
- Il n’existe pas de liaisons O-O dans ces composés.
- Il n’y a pas de liaisons covalentes DATIVES dans ces composés.
4-a) En l’abscence de liaisons datives quel(s) nombre(s) de liaisons(s) est possible autour de l’atome de phosphore ?

P peut faire un maximum de 5 liaisons en l'absence de liaisons datives
4-b) Montrer qu’une seule structure de Lewis est possible pour H3PO4.
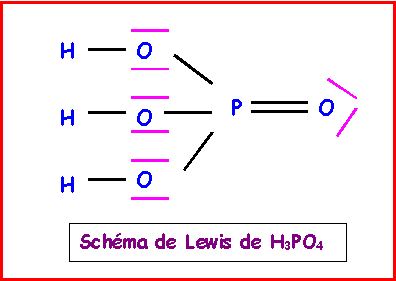
4-c) Calculer les valeurs des pKa successifs de H3PO4 puis les comparer aux valeurs expérimentales pK1 = 2,12 - pK2 = 7,21 pK3 = 12,67
pKa = 8 - 5n + 9z
pK1 = 8 - ( 5 * 1 ) + ( 9 * 0 ) = 3
pK2 = 8 - ( 5 * 2 ) + ( 9 * 1 ) = 7
pK3 = 8 - ( 5 * 3 ) + ( 9 * 2) = 11
L'ordre de grandeur est correct, cette formule empirique simple permet bien de prévoir approximativement les pKa successifs de H3PO4.
4-d) Montrer que deux structures de Lewis sont possibles pour H3PO2
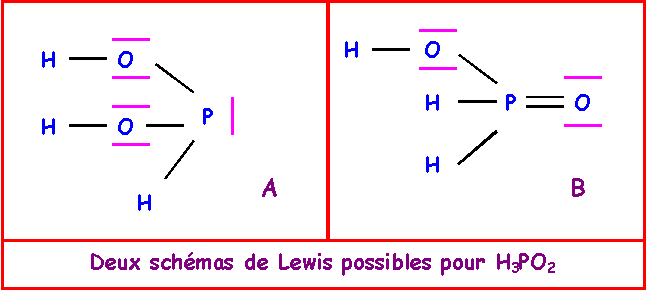
4-e) Montrer que deux structures de Lewis sont possibles pour H3PO3
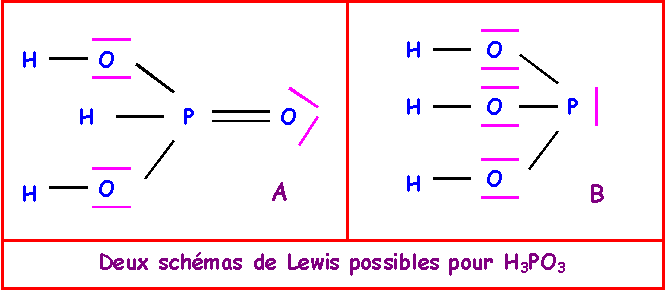
4-f) On donne les valeurs expérimentales des pKa de H3PO3 : pK1 = 2 et pK2 = 6,6
Quelle est la structure de Lewis de cet acide ?
Structure A :
pKa = 8 - 5n + 9z
pK1 = 8 - ( 5 * 1 ) + ( 9 * 0 ) = 3
pK2 = 8 - ( 5 * 2 ) + ( 9 * 1 ) = 7
Structure B :
pKa = 8 - 5n + 9z
pK1 = 8 - ( 5 * 0 ) + ( 9 * 0 ) = 8
pK2 = 8 - ( 5 * 1 ) + ( 9 * 1 ) = 12
pK3 = 8 - ( 5 * 2 ) + ( 9 * 2 ) = 16
Seule la structure A peut convenir.
Exercice 5 :
Le composé le plus simple entre l’azote et le carbone est le composé de formule CN.
Ce composé est très instable mais a néanmoins été détecté dans l’espace interstellaire et dans l’atmosphère de certaines comètes. Les données expérimentales concernant ce composé montre que la longueur de la liaison CN est de 1,1718 A°.
Utilisation du modèle de Lewis
1-1)
Le nombre total d’électron est impair et il y a donc un électron célibataire dans cette molécule
.Il s’agit d’un RADICAL.
PARAMAGNETISME.
Proposez pour ce composé deux structures de Lewis différentes dans lesquelles on attribuera l’électron célibataire à l’atome d’Azote (structure A) ou à l’atome de carbone (structure B).
On se limitera aux seules formes mésomères NON CHARGEES
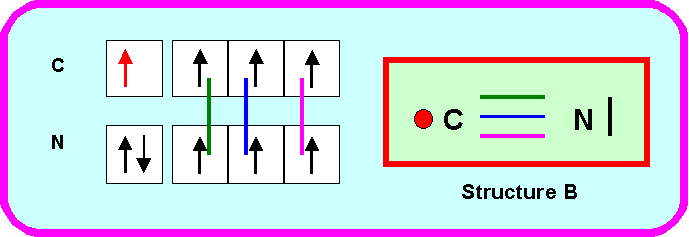
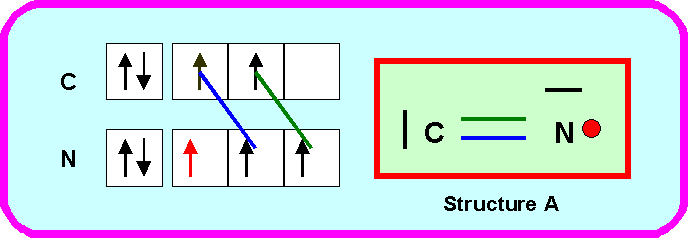
A partir du radical CN on peut facilement obtenir un composé hydrogéné NCH (éléments classés dans l'ordre alphabétique de leur nom)
Proposer deux structures de Lewis A’ (dérivant directement de A) et B’ (dérivant directement de B) pour ce composé hydrogéné.
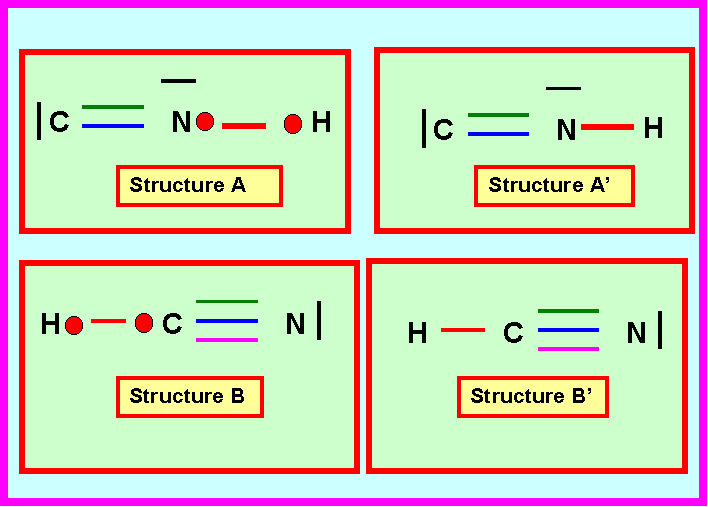
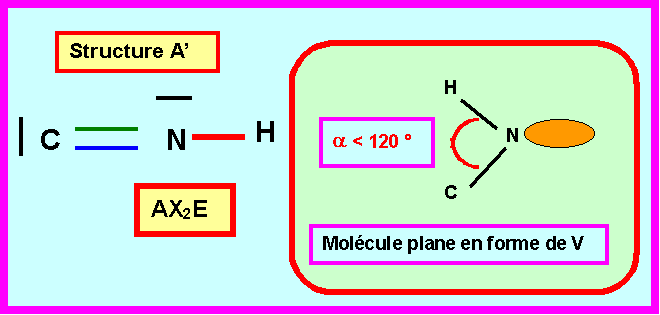
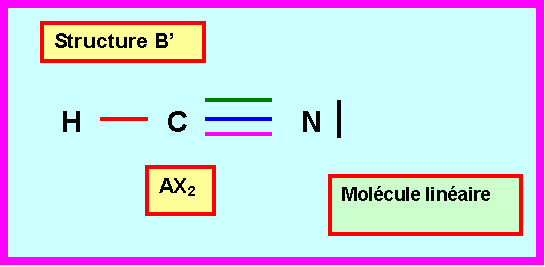
Prévoir la géométrie moléculaire, les angles et les longueurs des liaisons pour les deux structures A’ et B’.
Longueur des liaisons :
Liaison N – H
:LNH = 1,11 ( 0,7415 + 0,346) - 0,203
= 1,004 A°Liaison C = N
:LC=N = 0,86 * [ 1,11 (0,7856+ 0,7415) - 0,203 ]
= 1,283 A°
Longueur des liaisons :
Liaison C – H :
LCH = 1,11 ( 0,7856 + 0,346) - 0,203 =
1,053 A°Liaison
LCN = 0,78 * [ 1,11 (0,7856+ 0,7415) - 0,203 ] =
1,164 A°Il existe bien un composé stable de formule NCH. Ce composé est nommé acide cyanhydrique et est un gaz extrêmement toxique et mortel même à très faibles doses. La détermination expérimentale de la géométrie de ce composé montre qu’il s’agit d’une molécule linéaire contenant deux liaisons différentes de longueurs respectives : 1,0657 A° et 1,1530 A°.
Quelle structure A’ ou B’ vous semble convenir pour ce composé ?
Attribuer les deux longueurs de liaisons expérimentales.
Seule la structure B’ linéaire peut convenir pour le composé CNH.
L’attribution des longueurs de liaison est la suivante :
|
Liaison |
Longueur calculée |
Longueur expérimentale |
Ecart % |
|
H - C |
1,053 A° |
1,0657 A° |
1,2 % |
|
C - N |
1,164 A° |
1,1530 A° |
0,95 % |
En déduire la structure de Lewis probable (structure A ou structure B) du radical CN.
La structure du radical CN est donc probablement la structure B.
Exercice 6 :
Un peu d’histoire :
La notion d'isomérie fut introduite par Berzélius, Wohler et Liebig en 1823. Wohler travaillait sur l’acide cyanique qu’il obtint à partir du cyanate d’argent et dans le même temps Liébig synthétisait l’acide fulminique à partir du fulminate de mercure un explosif puissant. Ces deux composés étaient bien différents l’un de l’autre de par leurs propriétés chimiques et pourtant les deux chimistes arrivèrent à une formule brute identique CHNO pour ces deux acides. Berzélius leur demanda de vérifier leurs résultats car il paraissait à l’époque impossible que deux composés soient si différents chimiquement et possèdent une même formule. Les deux savants refirent leurs expériences et conclurent qu’il s’agissait bien de deux composés différents ayant la même formule. Ce fut le premier cas d’isomérie qui fut découvert et Berzélius émit l’hypothèse que c’était la manière dont les atomes s’unissaient entre eux qui était différente et conduisait à des propriétés chimiques différentes. Les chimistes furent alors amenés à s’intéresser à la structure spatiale des molécules et non plus seulement à leur formule brute. Ce fut un pas décisif dans l’histoire de la Chimie…
L’enchaînement des atomes est le suivant : C N O H
Donner le schéma de Lewis d'une forme mésomère obéissant à la règle de l'octet mais faisant apparaître des charges formelles . Préciser la géométrie.
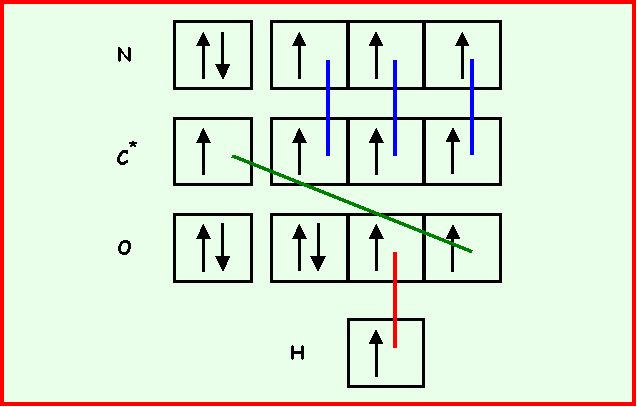
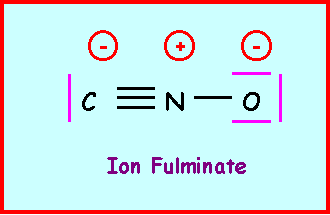 Donner le schéma de Lewis de l'ion fulminate. Justifier son instabilité (explosif).
Donner le schéma de Lewis de l'ion fulminate. Justifier son instabilité (explosif).
Cet ion est instable puisque cette structure comporte trois charges et que de plus, l'électronégativité des atomes n'est pas respectée ( XN > XC ).
2)
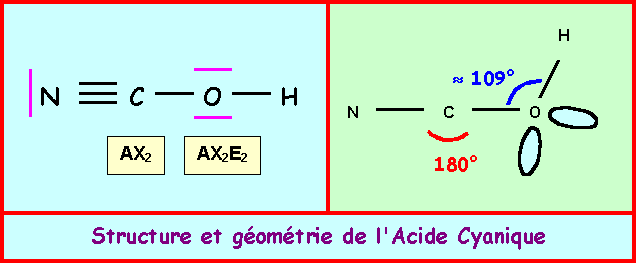
Acide Cyanique et ion cyanate :L’enchaînement des atomes est le suivant : N C O H
Donner le schéma de Lewis correspondant . Préciser la géométrie.
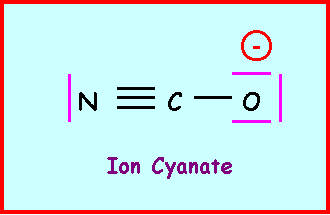
Donner le schéma de Lewis de l’ion cyanate NCO-
3)
Mésomérie de l'ion cyanatePour cet ion montrer qu’on peut écrire une forme mésomère pour laquelle la charge négative n’est pas portée par l’atome d’oxygène mais par l’atome d’azote.
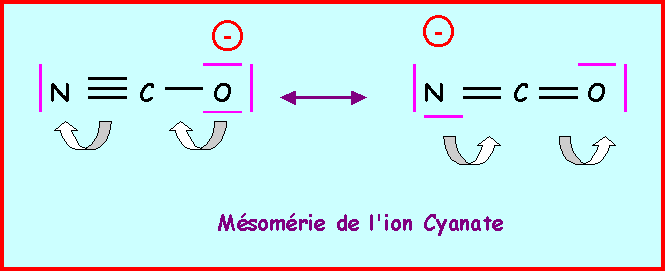
4)
Acide isocyanique :La deuxième forme mésomère de l’ion cyanate est appelée ion isocyanate. Cet ion peut théoriquement conduire à l’acide isocyanique isomère des acides cyanique et fulminique. Donner le schéma de Lewis de cet acide isocyanique.