Deuxième série de T.D
Electronégativité de Pauling - Liaisons Polarisées - Moments dipolaires
Exercice 1 :
Soient les énergies de dissociation suivantes en kJ mol-1
H2 435 ; F2 155 ; Cl2 242 ; Br2 192 ; I2 150 ; HF 566 ; HCl 431 ; HBr 366 ; HI 299
1) Déterminer les électronégativités selon Pauling des atomes F, Cl, Br et I
On prendra X = 2,2 pour H.
H2 |
F2 |
Cl2 |
Br2 |
I2 |
HF |
HCl |
HBr |
HI |
|
E (eV) |
4,51 |
1,61 |
2,51 |
1,99 |
1,55 |
5,87 |
4,47 |
3,79 |
3,10 |
On sait que HF, HCl, HBr et HI sont tous des acides se dissociant en X- et H+, tous les halogènes sont donc plus électronégatif que H.
On peut calculer l'électronégativité de Pauling en utilisant soit la moyenne arithmétique, soit la moyenne géométrique.
Moyenne arithmétique : DX2 = EAB - 1/2 ( EAA+EBB )
DX2 |
DX |
X |
|
F |
2,81 |
1,68 |
3,88 |
Cl |
0,96 |
0,98 |
3,18 |
Br |
0,54 |
0,74 |
2,94 |
I |
0,07 |
0,26 |
2,46 |
Moyenne géométrique : DX2 = EAB - Ö (EAA EBB)
DX2 |
DX |
X |
|
F |
3,17 |
1,78 |
3,98 |
Cl |
1,10 |
1,05 |
3,25 |
Br |
0,80 |
0,89 |
3,09 |
I |
0,45 |
0,67 |
2,87 |
Les deux méthodes de calcul sont peu différentes mais c'est la moyenne géométrique qui est utilisée le plus fréquemment. C'est celle que nous utiliserons pour la suite de l'exercice.
On donne les moments dipolaires et les longueurs de liaisons suivant :
H ---- F |
m = 1,82 D |
d = 0,92 A° |
H ---- Cl |
m = 1,08 D |
d = 1,27 A° |
H ---- Br |
m = 0,79 D |
d = 1,42 A° |
H ---- I |
m = 0,38 D |
d = 1,61 A° |
2) Calculer la charge partielle portée par chaque atome dans les molécules :
HF ; HCl ; HBr et HI
m = d * d
d = m / d
d en Coulomb si m en C.m et d en m
3) Calculer le pourcentage d'ionicité des liaisons.
%I = d / e * 100
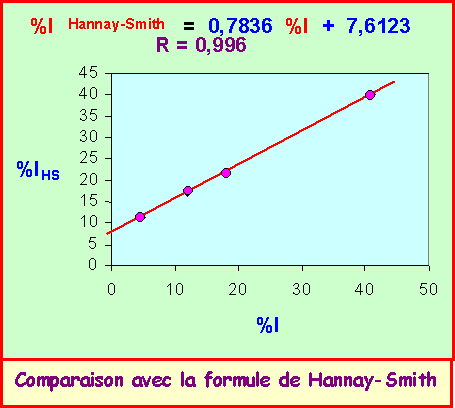
4) Comparer les valeurs obtenues avec celles données par la formule empirique de Hanay-Smith %IAB » 16 DX + 3,5 DX2
(Pour mieux se rendre compte de l'accord éventuel on fera une régression linéaire)
m (D) |
d(A°) |
d = m / d (C) |
%I |
DX |
%IH.S |
|
| H ---- F | 1,82 |
0,92 |
6,59E-20 |
41 |
1,78 |
40 |
| H ---- Cl | 1,08 |
1,27 |
2,83E-20 |
18 |
1,05 |
21 |
| H ---- Br | 0,79 |
1,42 |
1,85E-20 |
12 |
0,89 |
17 |
| H ---- I | 0,38 |
1,61 |
7,86E-21 |
5 |
0,67 |
12 |
La formule de Hannay-Smith donne un assez bon résultat pour HF et HCl c'est à dire pour des liaisons assez fortement polarisées. Pour les liaisons faiblement polarisées cette formule ne donne pas de très bons résultats. Il existe néanmoins une relation linéaire entre les valeurs calculées à partir de m et d et celles obtenues par la formule de Hannay-Smith.

Exercice 2 :
Le moment dipolaire du mono-sulfure de carbone CS est de 1,98 D et la longueur de la liaison est de 1,53 A°.
a) Vérifier par le calcul la longueur de liaison expérimentale
Formule de calcul des longueurs de liaisons :
Simple liaison : L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
double = 86% de la simple - triple = 78% de la simple
Calcul de Z*C
C : 1 s2 - 2s2 2p2
Z*C = 6 - ( 3 * 0,35 ) - ( 2 * 0,85 ) = 3,25
soit n*2 / Z* = 4 / 3,25 = 1,2308
Calcul de Z*S
S : 1 s2 - 2s2 2p6 - 3 s2 3 p4
Z*C = 16 - ( 5 * 0,35 ) - ( 8 * 0,85 ) - ( 2 * 1 ) = 5,45
soit n*2 / Z* = 9 / 5,45 = 1,6514
Calcul de la longueur de liaison simple CS :
L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
L (A°) = 0,239 ( 1,2308 + 1,6514 ) + 0,164 ( 2 + 3 ) + 0,297 = 1,806 A°
Simple liaison CS : 1,806 A°
Double liaison CS : 0,86 * 1,806 = 1,553 A°
Triple liaison CS : 0,78 * 1,806 = 1,409 A°
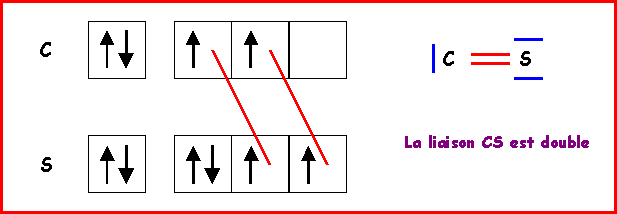
La longueur de liaison CS doit donc être proche de 1,55 A°
La longueur expérimentale est de 1,53 A°
soit un écart de (1,55 - 1,53 ) / 1,53 = 0,015 soit 1,5 %.
Remarque : On peut éventuellement faire intervenir une forme mésomère à triple liaison, ce qui raccourcirait la liaison. Mais des charges sont alors présentes et de plus en désaccord avec l'électronégativité légèrement supérieure de S. Bien que respectant la règle de l'octet cette forme mésomère semble donc avoir un très faible poids statistique. La liaison réelle doit donc être très proche de la double liaison.
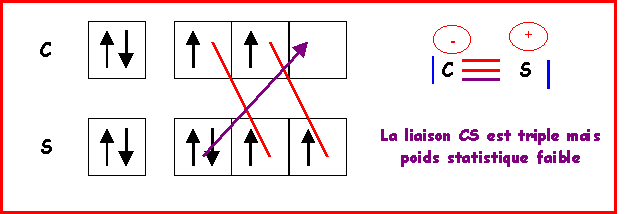
b) Calculer la charge partielle portée par chaque atome.
m = 1,98 D = 1,98 * 0,333 10-29 = 6,59 10-30 C . m
m = d * d
d = m / d = 6,59 10-30 / 1,53 10-10 = 4,309 10-20 C = 0,27 e
c) Calculer le caractère ionique partiel de la liaison C- S .
La liaison est à 27 % ionique.
Remarque :
On trouve un pourcentage d'ionicité très élevé, or C et S ont des électronégatvités très proche (XC =2,55 et XS = 2,58) la liaison devrait donc être faiblement polarisée et le moment dipolaire faible. Ce paradoxe peut être en partie expliqué par la présence de doublets libres qui possèdent un moment dipolaire propre dont on n'a pas tenu compte dans le calcul. Le moment dipolaire de la molécule est donc en réalité différent de celui de la liaison C-S et on ne peut donc déduire le pourcentage d'ionicité de la liaison C-S aussi simplement.
Dans la pratique on est souvent amené à négliger les moments dipolaires dus aux doublets libre ce qui peut parfois fausser les résultats.
Exercice 3 :
Sachant que le moment dipolaire partiel de liaison mN-O est de 0,15 D :
a) calculer le moment dipolaire global de l’ion NO3-.
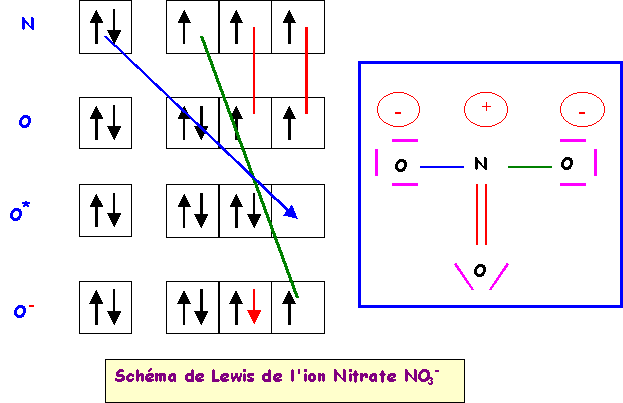
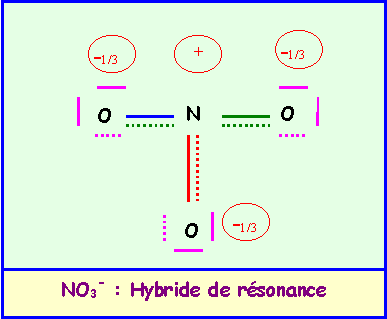
La géométrie de cet ion est du type AX3 parfaitement symétrique, triangle équilatéral parfait avec trois angles de 120° exactement. En raison de cette symétrie parfaite le moment dipolaire global de NO3- sera nul, en effet la résultante de deux des vecteurs mNO donne un vecteur exactement opposé au troisième vecteur mNO et il y a donc annulation du moment dipolaire global. Cela se voit facilement graphiquement mais on peut aussi le vérifier par le calcul.
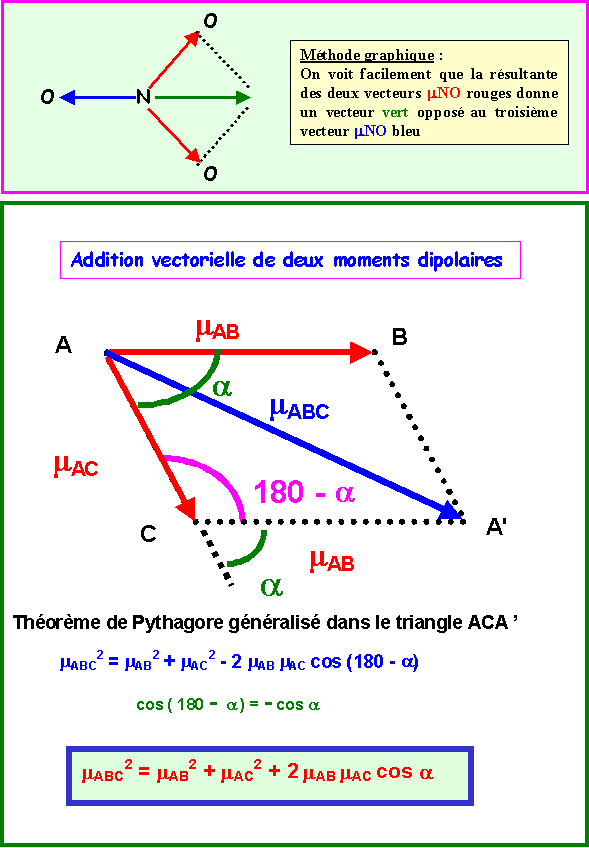
Dans notre cas : a = 120° et cos a = -0,5, de plus, mAB = mAC
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = 2 mAB2 + 2 mAB2 * -0,5
mABC2 = 2 mAB2 - mAB2 = mAB2
mABC = mAB
On obtient bien un vecteur opposé au troisième è Résultante totale nulle.
b) calculer le moment dipolaire global de la molécule NO2 (a = 134°).
Dans ce cas : a = 134° et cos a = -0,695, de plus, mAB = mAC
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = 2 mAB2 + 2 mAB2 cos a = 2 mAB2 ( 1 - cos a )
mABC2 = 2 * 0,15 * ( 1 + 0,695 ) = 0,5085
mABC = 0,713 D
mNO2 = 0,713 D
Exercice 4 :
Electronégativités de Pauling :As ( X = 2,2 ) - Br : ( X = 2,96 ) - Cl ( X = 3,16 )
Moments dipolaires des liaisons : As - Cl : m = 1,3 D - As - Br : m = 1,6 D
AsBr2Cl3
Soit le composé de formule AsBr2Cl3
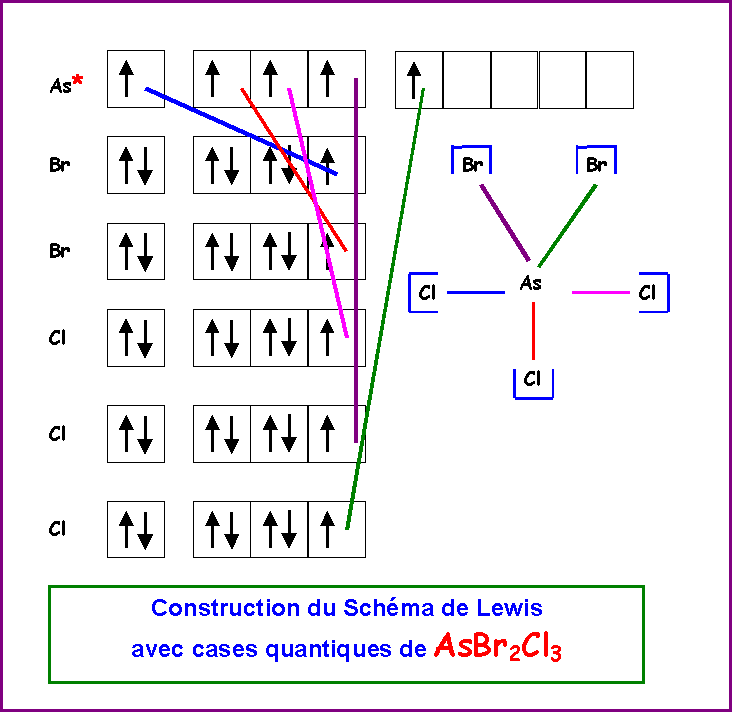
La géométrie autour de As est du type AX5 soit une bi-pyramide à base triangle, les sommets ne sont pas équivalents, il existe trois sommets équatoriaux et deux sommets axiaux.
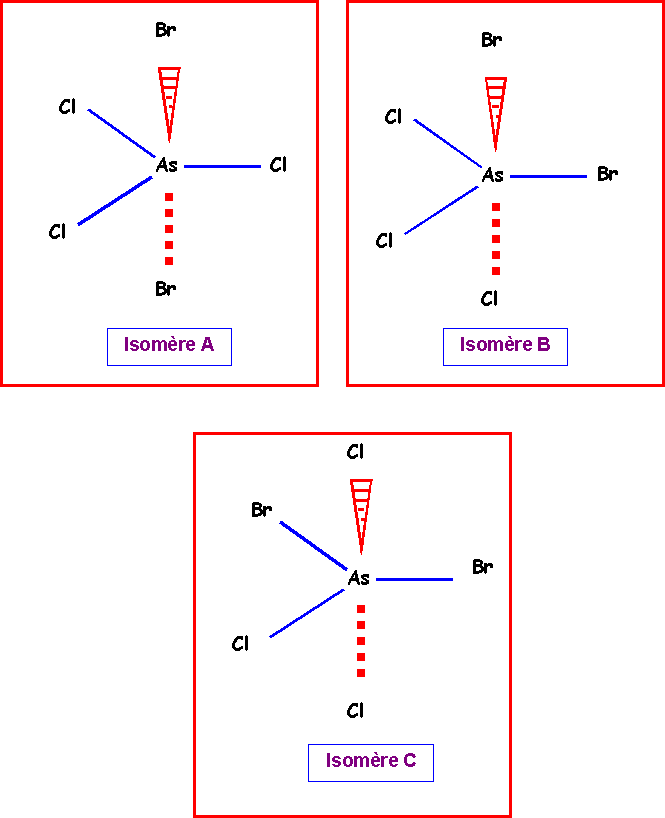
On pourra donc placer les atomes latéraux de trois manières différentes :
Isomère A :
2 Bromes axiaux et 3 chlores équatoriaux.
Isomère B :
1 Brome axial, 1 Brome équatorial, 1 chlore équatorial et 2 chlores axiaux.
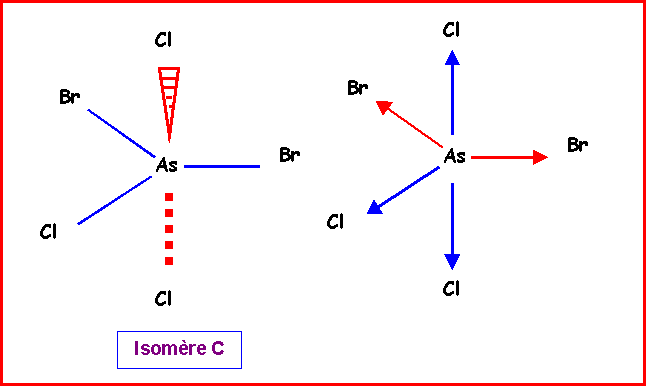
Isomère C :
2 Bromes équatoriaux , 2 Chlores axiaux et 1 Chlore équatorial.
Electronégativités dans l'échelle de Pauling :
As ( X = 2,2 ) - Br : ( X = 2,96 ) - Cl ( X = 3,16 )
Liaison As - Br :
Br plus électronégatif que As attire les électrons de la liaison vers lui, la liaison AsBr est donc polarisée.
Liaison As - Cl :
Cl plus électronégatif que As attire les électrons de la liaison vers lui, la liaison AsCl est donc polarisée.
Le Chlore étant plus électronégatif que le Brome la polarisation des liaisons AsCl est plus importante que celle des liaisons AsBr.
Conséquences :
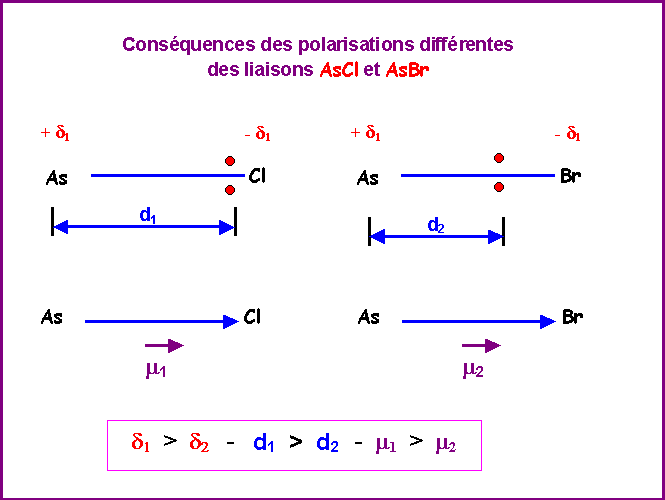
L'existence de ces dissymétries va se répercuter sur les stabilités relatives des trois isomères. L'isomère le plus stable sera celui pour lequel les répulsions entre doublets seront minimales, c'est à dire celui pour qui les doublets seront le plus éloignés de l'atome central. L'atome le moins électronégatif (ici Br) se placera donc préférentiellement en positions équatoriales (angles de 120°) plutôt qu'en positions axiales (angles de 90° uniquement).
L'ordre de stabilité croissante est donc :
Isomère A < isomère B < isomère C
( 2 Br axiaux) < (1 Br équatorial) < (2 Br équatoriaux )
Remarque :
Les atomes peu électronégatifs attirant peu les électrons sont de gros atomes
Les atomes très électronégatifs attirant fortement les électrons sont de petits atomes.
Le raisonnement plus simple (mais moins rigoureux) consistant à se baser sur la taille de l'atome en disant que les gros atomes se placent préférentiellement en position équatoriale car ils y trouvent plus de place (encombrement stérique) conduit donc au même résultat qualitatif.
Isomère A :
On voit facilement sur la représentation spatiale que les deux vecteurs correspondant aux moments dipolaires des liaisons AsBr s'annulent mutuellement.
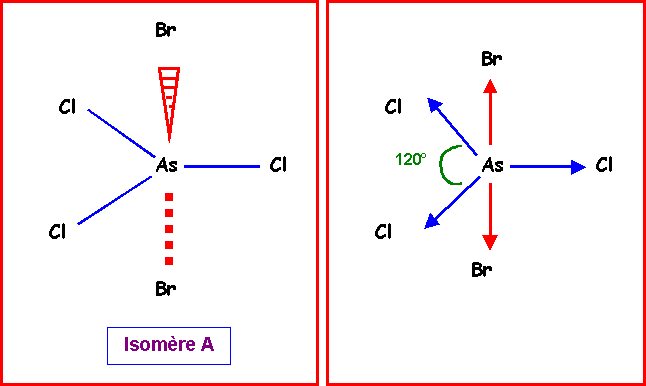
De plus, la résultante de deux vecteurs mAsCl donne un vecteur opposé au troisième. Les trois vecteurs mAsCl s'annulent donc les uns les autres et leur résultante est nulle.
On peut le vérifier par le calcul :
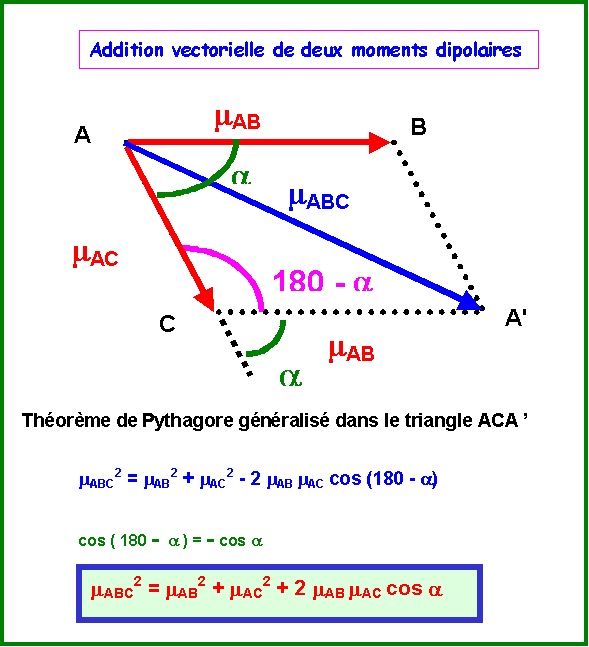
Dans le cas qui nous intéresse :
mAB = mAC = mAsCl et a = 120°
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = mAsCl2 + mAsCl2 + 2 mAsCl mAsCl cos 120
mABC2 = 2 mAsCl2 ( 1 + cos 120 )
mABC2 = 2 mAsCl2 ( 1 - 0,5 )
mABC2 = mAsCl2
mABC = mAsCl
La somme des deux vecteurs mAsCl équatoriaux donne bien un vecteur opposé au troisième.
Finalement le moment dipolaire global de l'isomère A est donc nul.
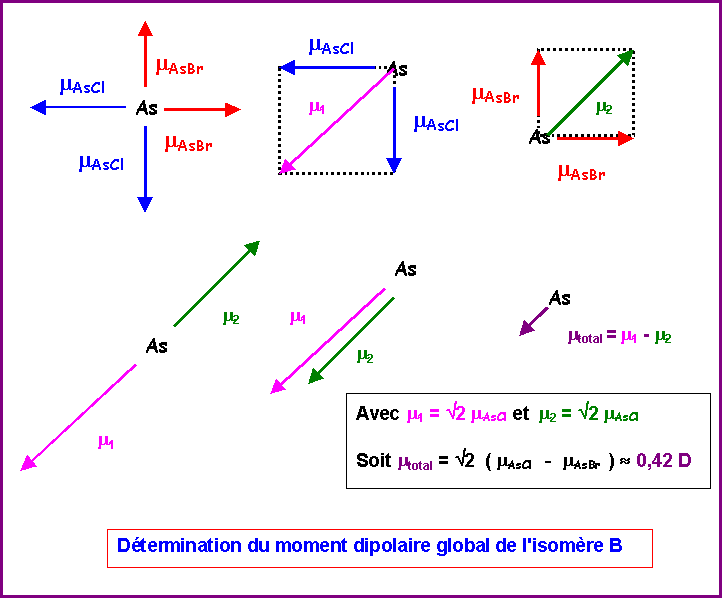
Isomère B :
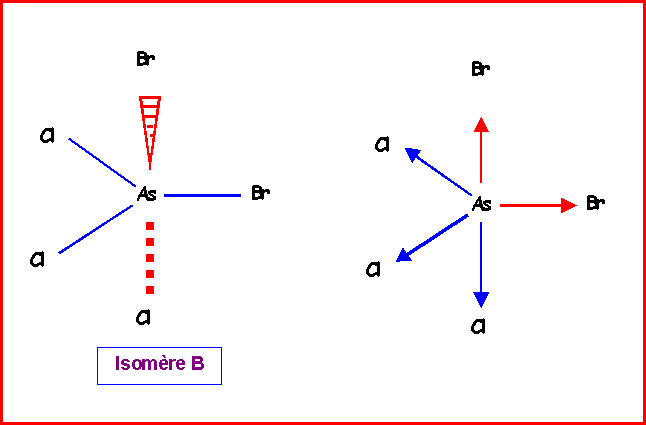
Nous venons de voir qu'on pouvait remplacer les deux vecteurs mAsCl équatoriaux par un seul de sens opposé au vecteur mAsBr équatorial. On peut ensuite additionner les deux vecteurs mAsBr orthogonaux entre eux et les deux vecteurs mAsBr orthogonaux entre eux également.
Soit :
mAB = mAC = mAsCl et a = 90°
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
mABC2 = mAsCl2 + mAsCl2 + 2 mAsCl mAsCl cos 90
mABC2 = 2 mAsCl2
mABC = Ö 2 mAsCl
De même pour les vecteurs mAsBr
mABC = Ö 2 mAsBr
Il suffit ensuite d'additionner les deux résultantes partielles (qui sont de sens opposé) pour obtenir le moment dipolaire global de l'isomère B.
m = Ö 2 ( mAsCl - mAsBr ) = Ö 2 ( 1,6 - 1,3 ) » 0,42 D
Isomère C :
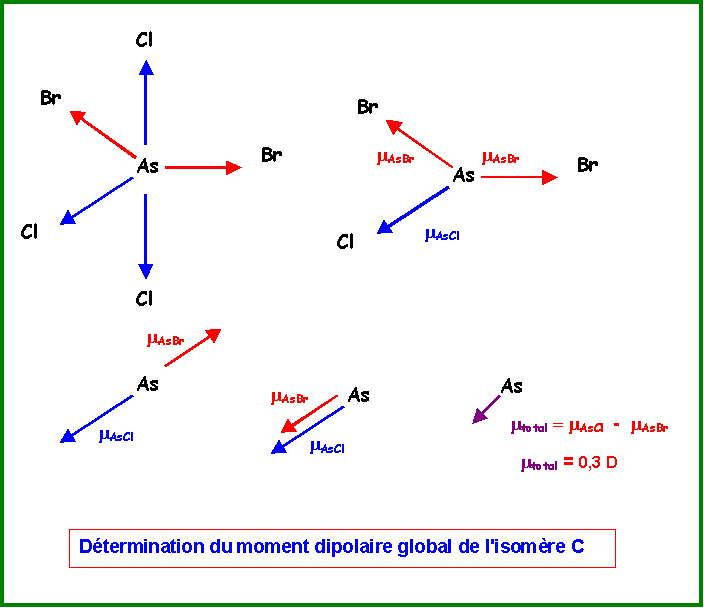
Ce cas est beaucoup plus simple que le précédant.
Les deux vecteurs mAsCl axiaux s'annulent mutuellement.
On remplace les deux vecteurs mAsBr équatoriaux par un seul de sens opposé au vecteur mAscl équatorial.
La résultante est donc mtotal = mAsCl - mAsBr = 1,6 - 1,3 = 0,3 D
Résumé :
Isomère |
Moment dipolaire global (en Debye) |
A |
0 |
B |
0,42 |
C |
0,3 |
Exercice 5 :
Quel moment dipolaire peut-on attribuer au chloroforme CHCl3 sachant que les moments partiels de liaisons sont mCH = 0,4 D et mCCl = 1,5 D
CHCl3 présente une géométrie tétraédrique de type AX4
Orientons d'abord les vecteurs moment dipolaire de liaison :
Classement des atomes par ordre d'électronégativité croissante : H < C < Cl
Liaison C-H : Vecteur mCH dirigé de H vers C
Liaison C-Cl : Vecteur mCCldirigé de C vers Cl
On pourrait chercher à résoudre ce problème géométrique par le calcul par addition vectorielle successives, mais il est plus simple de tenir compte des simplifications pour raison de symétrie.
Pour des raisons de symétrie (voir figure) les molécules de type AX4 comme CCl4 ne possèdent pas de moment dipolaire permanent, en effet les moments dipolaires partiels des liaisons C- Cl s'annulent deux à deux et le moment global résultant est nul.
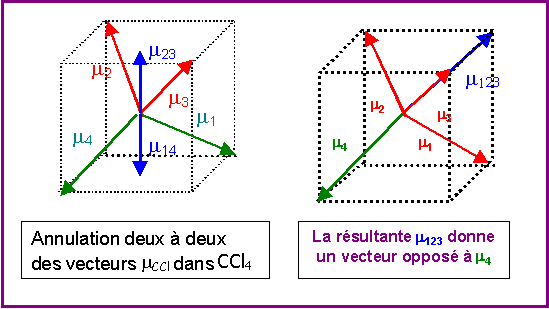
On peut donc considérer simplement que l'addition vectorielle de 3 moments de liaisons C-Cl donne un vecteur exactement opposé a moment dipolaire de la quatrième liaison C-Cl
On peut donc remplacer 3 vecteurs mCCl par un seul opposé au 4ème.
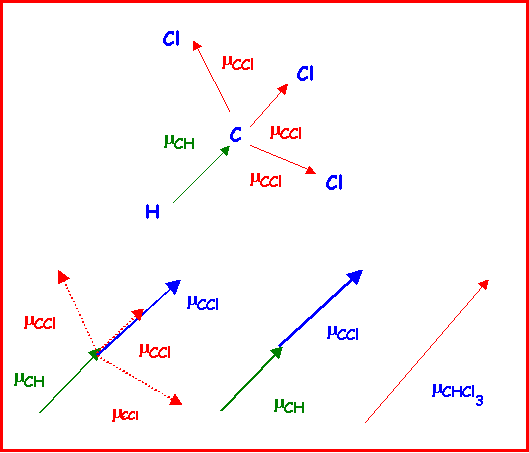
On peut utiliser cette propriété pour calculer facilement le moment dipolaire global de CHCl3. On suppose pour simplifier que CHCl3 à une géométrie tétraédrique parfaite.
On remplace les trois vecteurs mCCl par un seul vecteur de même norme et dont on sait qu'il se trouve dans le prolongement du vecteur mCH. Le moment global est la somme de ces deux vecteurs colinéaires et de même sens.
Soit mCHCl3 = mCH + mCCl = 0,4 + 1,5 = 1,9 D