Troisième série de T.D
Intéractions de faibles énergies - Liaisons Hydrogène
Exercice 1 :
Le butane (gazeux sous 1 bar à 298 K) et l’acétone (liquide sous 1 bar à 298 K) ont des points d’ébullition et des points de fusion très différents bien qu’ils aient tous deux la même masse molaire.
Attribuer à chacun son point d’ébullition et son point d’ébullition.
Justifier les différences observées.
T1 = - 138 °C - T2 = - 0,5 °C - T3 = - 95°C - T4 = + 56°C
Cas du Butane : CH3 - CH2 - CH2 - CH3
Le butane ne présente que des liaisons C -C et C -H.
Les liaisons C - C sont évidemment non polarisées.
Les liaisons C - H le sont très peu car C et H ont des électronégativités très proches.
XC = 2,6 et XH = 2,2 dans l'échelle de Pauling.
Le butane ne présente donc aucune liaisons fortement polarisées et présentera donc peu d'interaction de type Keesom entre moments dipolaires permanents.
Il n'y aura donc pas d'interactions intermoléculaires et le butane aura donc des températures de changement d'état "normales".
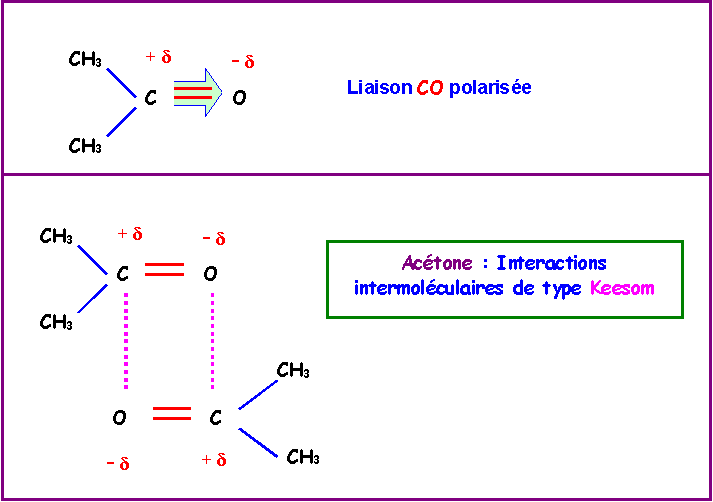
Cas de l'Acétone : CH3 - CO - CH3
En revanche, l'acétone présente une liaisons C = O fortement polarisée ( XO = 3,4 ) et les interaction de Keesom seront importantes pour ce composé.
Il y aura donc de fortes interactions intermoléculaires et l'Acétone présentera des températures de changement d'état "anormalement" élevées puisqu'il faudra briser toutes ces "liaisons" intermoléculaires.

L'attribution des températures de changement d'état est donc le suivant :
T1 = -138°C et T3 = -95°C qui sont les deux températures les plus basses sont les deux points de fusion et l'acétone correspond au plus élevé, soit T3.
T2 = -0,5°C et T4 = +56°C qui sont les deux températures les plus élevées sont les deux points d'ébullition et l'acétone correspond au plus élevé, soit T4.
Butane |
Acétone |
|
Point de Fusion |
T1 = - 138 °C |
T3 = - 95°C |
Température d'Ebullition |
T2 = - 0,5 °C |
T4 = + 56°C |
Exercice 2 :
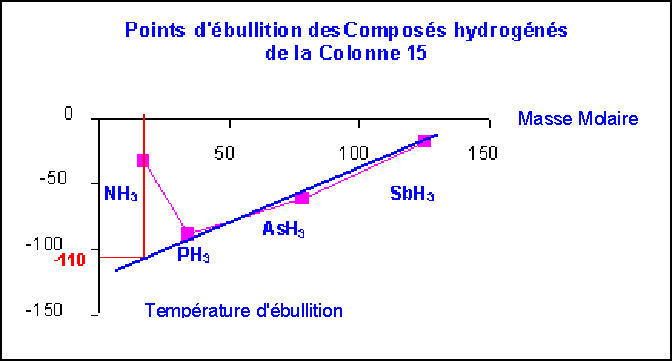
On donne les masses molaires et les points d’ébullition des composés hydrogénés des éléments de la colonne 15 de la classification périodique :
NH3, PH3, AsH3 et SbH3
M (g mol-1) |
Teb (°C) |
|
| NH3 | 17 |
-33 |
| PH3 | 34 |
-87 |
| AsH3 | 78 |
-55 |
| SbH3 | 181 |
-17 |
Montrer que l’un des composés possède un point d’ébullition " anormal ". Lequel ?
Evaluer le point d’ébullition que devrait avoir " normalement " ce composé.
Justifier cette anomalie.
Une représentation graphique montre clairement que NH3 présente des températures de changement d'état anormalement élevées par rapport aux autres composés hydrogénés des éléments de la même colonne.
On explique cela par l'existence de fortes interactions de Keesom dues au liaisons N-H fortement polarisées (XN = 3,0 et XH = 2,2).
Ces interactions particulièrement importantes sont nommées liaisons Hydrogène.
On peut estimer graphiquement que NH3 devrait avoir un point d'ébullition d'environ - 110°C si ces interactions n'existaient pas.
Exercice 3 :
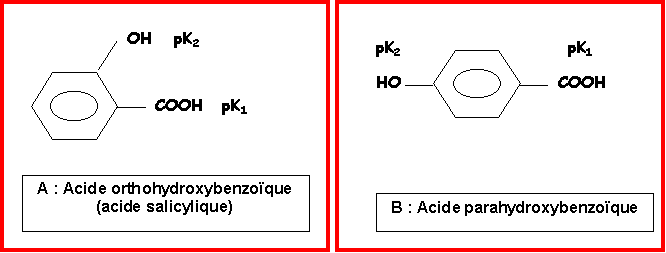
Soient les deux composés isomères suivants :
1) Les points de fusion de ces deux composés sont de 159°C pour l'un et 215°C pour l'autre. Attribuer a chacun son point de fusion.
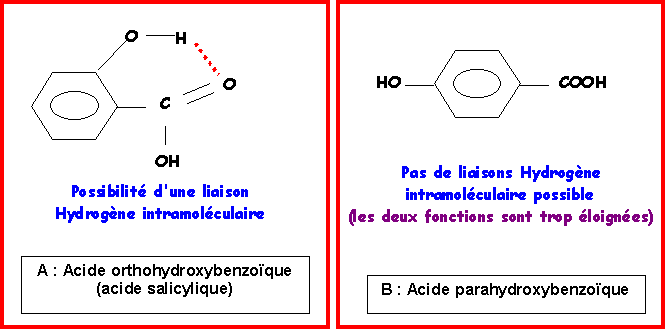
L'acide salicylique présentant une liaison Hydrogène intramoléculaire (entre atomes appartenant à la même molécule) verra son point de fusion fortement abaissé car les molécules sont mieux individualisées. En revanche, pour l'acide parahydroxybenzoïque la présence de liaisons Hydrogène intermoléculaires (entre atomes appartenant à des molécules différentes) provoque le phénomène inverse, les molécules étant liées entre elles, il faudra plus d'énergie pour les séparer et donc on observera un point de fusion plus élevé.
L'attribution des points de fusion est donc la suivante :
acide orthohydroxybenzoïque (salicylique) : Tfusion = 159 °C
acide parahydroxybenzoïque : Tfusion = 215 °C
2) On donne les quatre valeurs de pKa suivantes : 2,8 - 4,3 - 9,1 - 12,3
Attribuer son pKa à chaque fonction acide.
Comparaisons des acidités des fonctions acide carboxylique R - COOH , alcool R -OH et phénol f - OH. Le symbole f désigne le groupement "noyau benzènique".
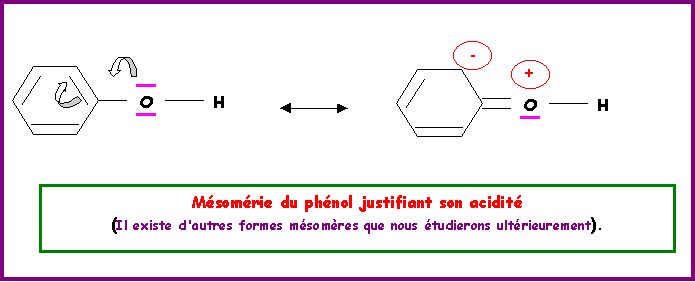
Ces trois fonctions présentent toutes le groupement O - H, cette liaison est fortement polarisée et peut se rompre assez facilement en donnant un ion H+ (proton) l'oxygène devenant porteur d'une charge négative. Ces trois fonctions sont donc bien acides puisqu'il y a libération d'un proton H+.
Comment classer les acidités relatives de ces trois fonctions ?
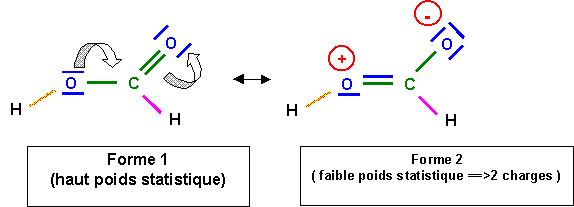
Les acides carboxyliques sont encore plus acides avec des pKa de l'ordre de 5.
Ici aussi, l'explication est l'existence de formes mésomères appauvrissant l'atome d'oxygène en électrons, ce qui fragilise la liaison O - H. L'intervention du deuxième atome d'oxygène très électronégatif fait que le phénomène est beaucoup plus important que dans le cas des phénols. Les acides carboxyliques sont donc beaucoup plus acides que les phénols
Ce classement qualitatif permet un premier tri entre les valeurs des pKa donnés :
pKa = 2,8 et 4,3 correspondent à la fonction acide carboxylique R- COOH.
pKa = 9,1 et 12,3 correspondent à la fonction phénol f - OH.
Il reste a attribuer les valeurs des pKa à chaque acide.
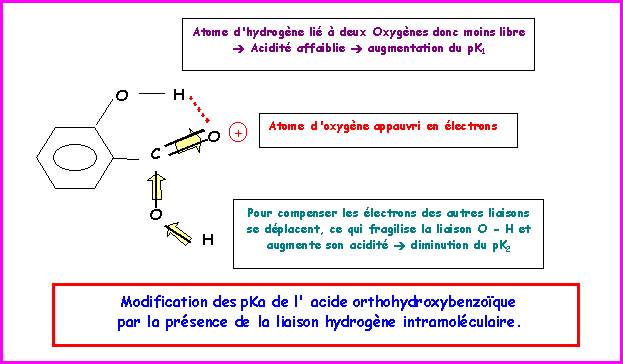
Le schéma suivant montre que l'acide orthohydroxybenzoïque voit l'acidité de sa fonction phénol diminuer et l'acidité de sa fonction acide carboxylique augmenter.
A cause de la liaison Hydrogène intramoléculaire, l'acide orthohydroxybenzoïque possédera donc le pK1 le plus petit et le pK2 le plus grand.
Les pKa de l'acide orthohydroxybenzoïque sont donc : pK1 = 2,8 et pK2 = 12,3.
Les pKa de l'acide parahydroxybenzoïque sont donc : pK1 = 4,3 et pK2 = 9,2.