Exercice 5 :
Le moment dipolaire du mono-sulfure de carbone CS est de 1,98 D et la longueur de liaison est de 1,53 A°.
a) Vérifier par le calcul la longueur de liaison expérimentale
Formule de calcul des longueurs de liaisons :
Simple liaison : L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
double = 86% de la simple - triple = 78% de la simple
Calcul de Z*C
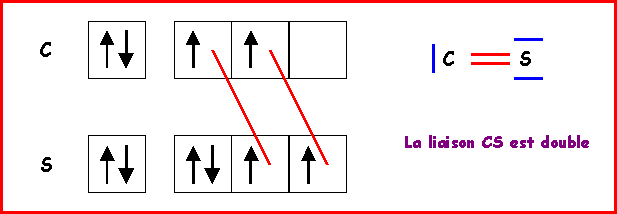
C : 1 s2 - 2s2 2p2
Z*C = 6 - ( 3 * 0,35 ) - ( 2 * 0,85 ) = 3,25
soit n*2 / Z* = 4 / 3,25 = 1,2308
Calcul de Z*S
S : 1 s2 - 2s2 2p6 - 3 s2 3 p4
Z*C = 16 - ( 5 * 0,35 ) - ( 8 * 0,85 ) - ( 2 * 1 ) = 5,45
soit n*2 / Z* = 9 / 5,45 = 1,6514
Calcul de la longueur de liaison simple CS :
L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297
L (A°) = 0,239 ( 1,2308 + 1,6514 ) + 0,164 ( 2 + 3 ) + 0,297 = 1,806 A°
Simple liaison CS : 1,806 A°
Double liaison CS : 0,86 * 1,806 = 1,553 A°
Triple liaison CS : 0,78 * 1,806 = 1,409 A°

La longueur de liaison CS doit donc être proche de 1,55 A°
La longueur expérimentale est de 1,53 A°
soit un écart de (1,55 - 1,53 ) / 1,53 = 0,015 soit 1,5 %.
b) Calculer la charge partielle portée par chaque atome.
m = 1,98 D = 1,98 * 0,333 10-29 = 6,59 10-30 C . m
m = d * d
d = m / d = 6,59 10-30 / 1,53 10-10 = 4,309 10-20 C = 0,27 e
c) Calculer le caractère ionique partiel de la liaison C- S .
La liaison est à 27 % ionique.
Remarque :
On trouve un pourcentage d'ionicité très élevé, or C et S ont des électronégatvités très proche (XC =2,55 et XS = 2,58) la liaison devrait donc être faiblement polarisée et le moment dipolaire faible. Ce paradoxe est du au doublets libres qui possèdent un moment dipolaire propre dont on n'a pas tenu compte dans le calcul. Le moment dipolaire de la molécule est donc en réalité différent de celui de la liaison C-S et on ne peut donc déduire le pourcentage d'ionicité de la liaison C-S aussi simplement.