Exercice 4 :
NO3- :
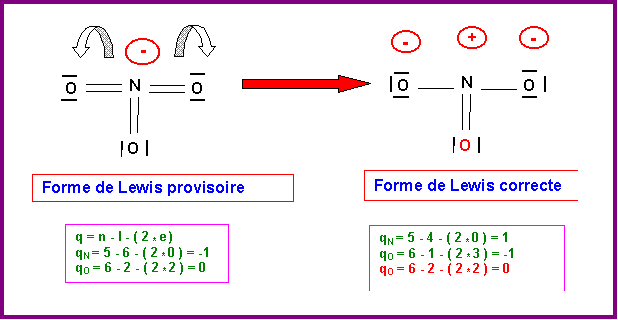
Détermination de la structure de Lewis : (Méthode "rapide")
N est l'atome central, il possède 5 électrons sur sa couche de valence. Si on lui attribue l'électron supplémentaire correspondant à la charge de l'ion, il possédera donc 6 électrons.
L'oxygène atome latéral est supposé former des doubles liaisons par ses deux électrons célibataires. N fera donc au total 6 liaisons avec les trois atomes d'oxygène. Les 6 électrons de N étant tous utilisés pour faire des liaisons il ne possède donc pas de doublets libres. Il possède en revanche un électron excédentaire et porte donc une charge formelle négative. La forme obtenue présente 6 liaisons pour N qui est un élément de la deuxième période et ne peut donc faire que 4 liaisons au maximum (une liaison par case quantique). Il faut donc supprimer 2 liaisons en rabattant les doublets correspondants sur les atomes d'oxygène.

Il existe en fait trois formes mésomères équivalentes en échangeant le rôle des oxygènes.
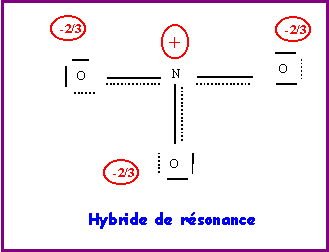
Les liaisons sont toutes identiques et les oxygènes indiscernables.
Le type moléculaire est AX3, la molécule sera plane triangulaire avec des angles de 120° exactement puisque parfaitement symétrique à cause des trois formes mésomères équivalentes.
Puisque O est plus électronégatif que N, la liaison sera polarisée N+d - O-d
Le moment dipolaire de liaison sera dirigé de N vers O.
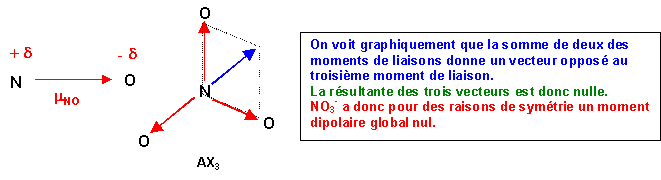
On pourrai retrouver ce résultat par le calcul (voir exercices précédants):
Ici a = 120° et cos a = - 0,5
m1,22 = m12 + m22 + 2 m1 m2 cos a
Avec de plus m1 = m2 = m
m1,22 = m2 + m2 + 2 m2 cos a = 2m2 ( 1 + cos a ) = 2m2 ( 1 - 0,5 ) = m2
La somme de deux des moments dipolaire de liaison est bien équivalente au troisième.
NO2 :
Le calcul du moment dipolaire global se fait sans difficulté particulière comme lors de l'étude de SO2 (voir exercice 3) avec ici a = 134°
mNO22 = 2 mNO2 ( 1 + cos a ) = 2 * 0,152 * ( 1 + cos 134 ) = 0,0137
mNO2 = 0,117 D