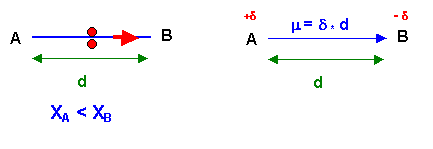
Exercice 2 :

d = m / d
Si d = e la liaison est purement ionique, le pourcentage d'ionicité s'exprime donc par le rapport d/e.
%IAB = 100 * d / e = (100 * m ) / ( d * e )
Attention aux unités dans le système international m s'exprime en C.m, d en m et e = 1,6 10-19 C.
Avec les unités couramment utilisées en chimie m est exprimé en Debye et d en Amstrong.
La formule devient : %IAB = 20,8 * m(D)/d(Å)
m (D) |
d (A°) |
%IAB |
|
H - Cl |
1,08 |
1,27 |
17,7 |
H - Br |
0,79 |
1,42 |
11,6 |
H - I |
0,38 |
1,61 |
4,9 |
On remarque que le pourcentage d'ionicité est directement relié à l'écart des électronégativités plus l'écart d'électronégativité est important et plus le pourcentage d'ionicité est élevé.
Cela est à la base de la formule empirique de Hanney-Smith %IAB = 16 DX + 3,5 DX2
ou de la formule plus complexe de Pauling %IAB = 100 ( 1 - exp(- (DX)2/4))
A titre de vérification de la validité de ces formules de calcul approchée, on peut vérifier pour HCl puisque nous avons déterminé XH et XCl dans l'exercice précédent : DX = 1,05.
Hanney-Smith : %IHCl = ( 16 * 1,05 ) + ( 3,5 * 1,052 ) = 20,6 %
Pauling : %IAB = 100 ( 1 - exp(- (1,05)2/4)) = 24 %
L'ordre de grandeur est donc correctement évalué par les deux formules.
La formule de Hanney-Smith donne généralement de bons résultats et est intéressante de part sa grande simplicité.