Exercice 3 :

La géométrie de la molécule est bien du type AX2E en forme de V avec un angle proche de 120°.
La valeur expérimentale de l'angle 119° est justifiée par la présence du doublet libre qui est pratiquement compensée par celles des deux doubles liaisons, l'effet du doublet libre l'emporte tout de même et l'angle est très légèrement inférieur à 120°.
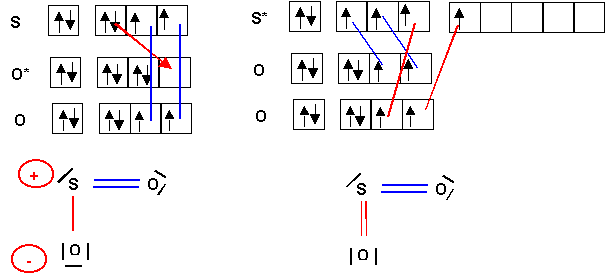
Si on examine les deux formes mésomères on accordera un poids statistique plus important à la forme à deux doubles liaisons et non chargée puisqu'elle possède à la fois d'avantage de liaisons et moins de charges que l'autre forme.
Remarque : la règle de l'octet n'est pas respectée pour cette forme alors qu'elle l'est pour l'autre, mais cette règle ne s'applique strictement qu'aux éléments de la deuxième période ce qui n'est pas le cas du soufre.
On peut aussi s'intéresser à la longueur expérimentale des liaisons.
Z*S = 5,45 , n*S = 3 , Z*O = 4,55, n*O = 2 soit pour les longueurs des liaisons S - O :
Simple 1,72 A° - Double : 1,48 A° - Triple 1,34 A°
La longueur réelle de la liaison de 1,43 A° est légèrement plus courte que la valeur approchée calculée pour la liaison double SO. Cela est en accord avec l'hypothèse que la forme mésomère à doubles liaisons est bien la forme la plus représentative de la molécule réelle. Nous verrons que le raccourcissement observé peut être attribué à la forte polarité de la liaison SO.
Calcul des charges partielles et du pourcentage d'ionicité :
Les moments dipolaires des liaisons s'ajoutent vectoriellement, leur résultante est le moment dipolaire global de la molécule. Ici le moment dipolaire global est connu et nous cherchons le moment dipolaire partiel d'une liaison SO qui nous permettra ensuite de déterminer le pourcentage d'ionicité de la liaison.
Nous négligerons le moment dipolaire partiel du au doublet libre qu'il est impossible d'évaluer.
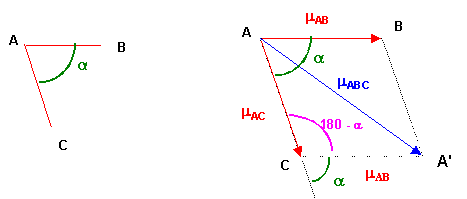
Théorème de Pythagore généralisé : Triangle ACA'
mABC2 = mAB2 + mAC2 - 2 mAB mAC cos (180 - a)
mABC2 = mAB2 + mAC2 + 2 mAB mAC cos a
Ici on à de plus mAB = mAC = mSO
mSO22 = mSO2 + mSO2 + 2 mSO mSO cos a
mSO22 = 2 mSO2 + 2 mSO2 cos a
mSO22 = 2 mSO2 ( 1 + cos a )
Soit mSO2 = mSO22 / 2 ( 1 + cos a )
Application numérique :
mSO2 = 1,652 / 2 ( 1 + cos 119 ) = 2,64
mSO = 1,625 D
%ISO = 20,8 * 1,625 / 1,43 = 23,6 %
Soit d = 0,24 e = 3,68 10-20 C
Cette liaison 24 % ionique est plus polarisée que la liaison H-Cl pour laquelle le pourcentage d'ionicité n'est que de 17 %, cette forte ionicité justifie le raccourcissement de la liaison observé.