Exercice 2 :
On s’intéresse aux molécules O2 et S2.
- Donner un diagramme décrivant la
molécule de dioxygène en utilisant l’approximation
C.L.O.A (Combinaison Linéaire d’Orbitales
Atomiques)
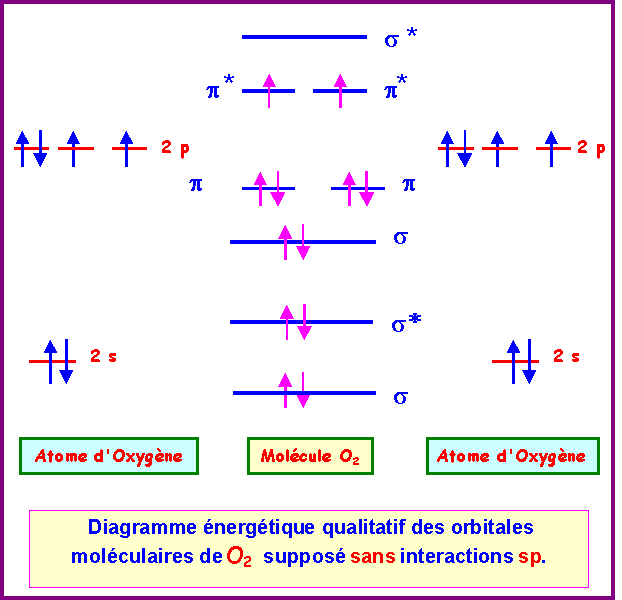
Si on suppose
que O2
est
sans interactions sp.
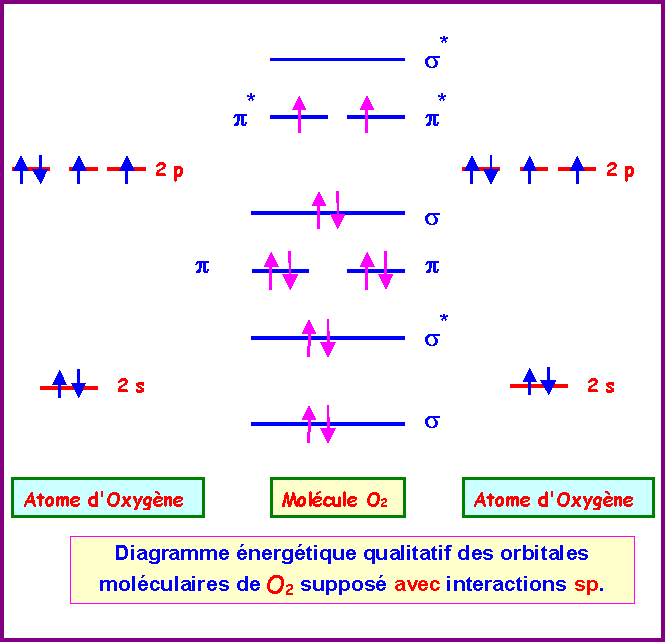
Si on suppose que O2 est avec interactions sp :
Cette molécule est-elle
Paramagnétique ou Diamagnétique ? Pourquoi ?
Les deux diagrammes obtenus,
avec ou sans interactions sp, montrent la présence de
deux électrons célibataires.
La
molécule O2 est donc
paramagnétique. Remarque
:
Les deux diagrammes (avec
ou sans interactions sp) sont en fait très peu
différents.
Ordre des O.M :
Sans interactions : s - s* - s - p p - p* p* - s*
Avec interactions : s -
s* - p p - s - p* p* - s*
Pour que les deux types de
remplissage conduisent à des différences
notables il faut que le nombre d'électrons a
placer dans les O.M soit compris entre 5 et 9.
Parmi les molécules
diatomiques homonucléaires seules Be2 et C2 conduiront à des différences
marquées selon le type de remplissage utilisé.
Cela était-il prévisible par la
théorie de Lewis ? Pourquoi ?
Dans le modèle de Lewis les électrons
sont toujours associés par paires, sauf bien entendu, s'ils sont
en nombre impair.
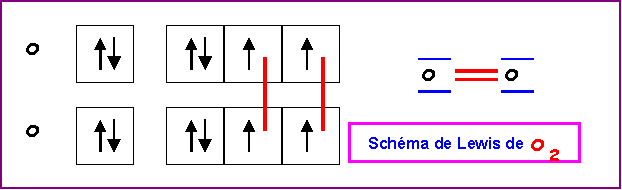
Il n'apparaît pas
d'électrons célibataires dans le schéma de Lewis de O2 qui semble donc être
diamagnétique.
d)
Pour la molécule S2 et les ions
moléculaires correspondants ( S2+
; S22+ ; S2- ; S22-) on trouve les résultats suivants pour les
distances de liaisons S-S :
d S-S (A°) 1,72 1,79 1,88 2 2,20
Attribuer à chaque espèce sa longueur de
liaison.
S et O appartiennent à la même
colonne de la classification périodique.
Nous supposerons que les
orbitales atomiques 3
d de S n'interviennent pas dans la
formation des liaisons dans S2.
Leurs orbitales
atomiques sont donc similaires et le diagramme des orbitales
moléculaires de S2 est semblable à celui de O2 établi précédemment.
Nous avons vu plus haut que
les diagrammes avec ou sans interaction conduiront aux même
conclusions puisque seules les molécules Be2 et C2 conduisent à des différences notables.
On sait d'autre part que O2 est en fait sans interactions sp à cause de
l'écart énergétique important entre les niveaux 2s et 2p.
Nous supposerons qu'il en
est de même pour S2 et nous utiliserons donc le diagramme sans
interactions sp.
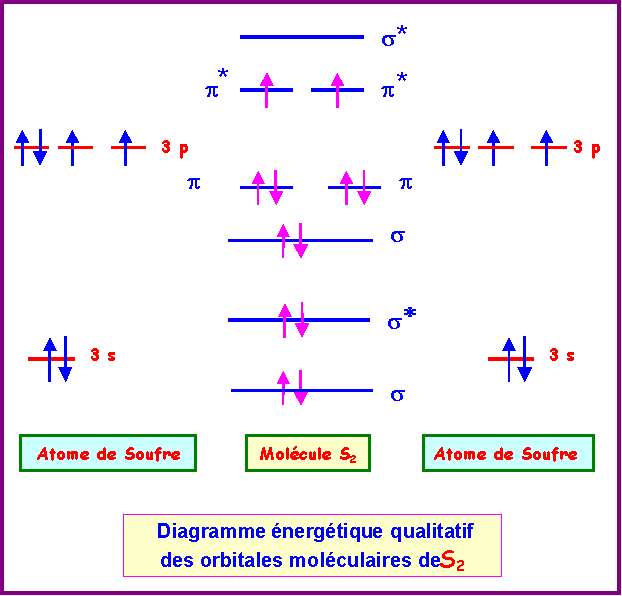
La configuration électronique de S2 peut s'écrire :
s12 - s1*2 - s22 - p12
- p22 - p1*1 - p2*1 - s2*0
Le dernier niveau occupé est un niveau anti-liant
de type p*.
Il contient 2 électrons et
peut encore en recevoir deux autres.
Si on ajoute 1 ou 2
électrons à la molécule S2 pour former S2- et S22- les deux électrons ajoutés
viendront finir de remplir ce niveau anti-liant.
Cela déstabilisera la
molécule, l'indice de liaison diminuera et la longueur de
liaison S-S augmentera.
nl = 1/2( n - n*)
Pour S2 : nl
= 1/2( n - n*) = 1/2 ( 8 - 4 ) = 2
Pour S2- : nl = 1/2( n - n*) = 1/2 ( 8
- 5 ) = 1,5
Pour S22- : nl = 1/2( n - n*) = 1/2 ( 8
- 6 ) = 1
Si on enlève 1 ou 2
électrons à la molécule S2 pour former S2+ et S22+ les deux électrons enlevés
partiront de ce niveau anti-liant.
Cela stabilisera la
molécule, l'indice de liaison augmentera et la longueur de
liaison S-S diminuera.
nl = 1/2 ( n - n* )
Pour S2 : nl
= 1/2 ( n - n*) = 1/2 ( 8 - 4 ) = 2
Pour S2+ : nl = 1/2 ( n - n*) = 1/2 (
8 - 3 ) = 2,5
Pour S22+ : nl = 1/2 ( n - n* ) = 1/2 (
8 - 2 ) = 3
Il est donc facile
d'attribuer les diverses longueurs de liaisons aux diverses
espèces :
| |
S22+
|
S2+
|
S2
|
S2-
|
S22-
|
Indice
de liaison
|
3
|
2,5
|
2
|
1,5
|
1
|
d S-S (A°)
|
1,72
|
1,79
|
1,88
|
2
|
2,20
|
Retour
aux énoncés



