
Exercice 4 :
La molécule de monoxyde d’azote NO est paramagnétique.
Cette molécule possède un nombre impair d'électrons, il s'agit d'un Radical.
L'électron célibataire est représenté par un point.

La molécule possédant un électron célibataire est donc bien paramagnétique.
(on supposera qu’il y a intéraction s-p)
L'atome d'Oxygène étant plus électronégatif que l'atome d'Azote ces niveaux énergétiques sont plus bas.
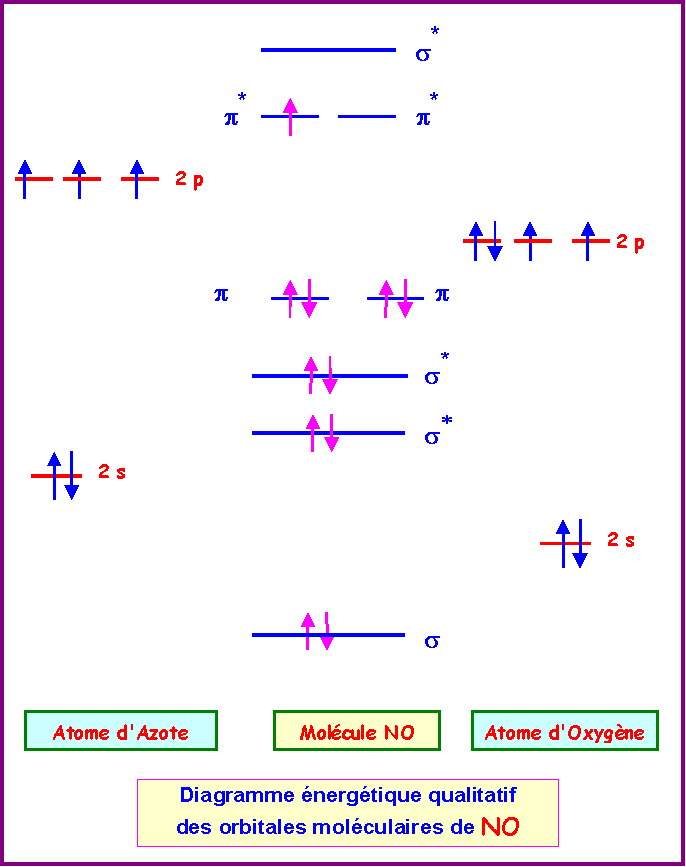
Il y a bien un électron célibataire (sur un niveau p*), la molécule est donc bien paramagnétique.
On utilise la formule approchée de calcul des longueurs de liaisons.
R (A°) = 0,215 (n*2/Z*) + 0,148 n* + 0,225
dA-B = 1,11 dCalc - 0,203
Liaison double = 86 % de la simple - Liaison triple = 78% de la simple
On obtient :
Z*N = 3,9
n*N = 2
RN = 0,742 A°
Z*O = 4,55
n*O = 2
RO = 0,71 A°
LNO Simple : 1,41 A° - LNO Double : 1,21 A° - LNO Triple : 1,10 A°
La longueur expérimentale de 1,15 A° est intermédiaire entre la double et la triple liaison.
Le calcul de l'indice de liaison confirme ce calcul approché :
nl = 1/2 ( 8 - 3 ) = 2,5
L'ionisation de NO en NO+ correspond à l'enlèvement d'un électron anti-liant et stabilise donc la molécule.
L'ion NO+ est donc facile à obtenir.
On remarque que NO+ est iso-électronique de N2 (10 électrons) sont indice de liaison est 3.
La liaison N-O sera plus courte dans NO+ que dans NO.