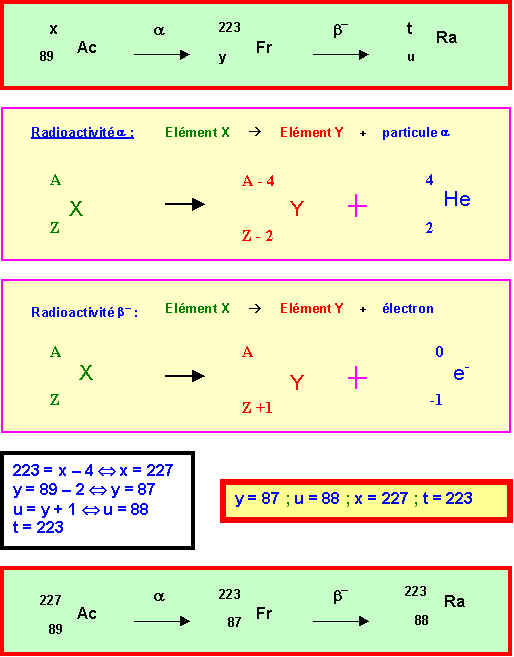
ATOMISTIQUE
Pb : Z = 82 et M = 207,2
M = 207,2 g mol-1 Û A = 207Þ N = A - Z = 207 - 82 = 125
Masse des électrons :
mélectrons = Z * me = 82 * 9,1095 10-31 @ 7,5 10-29 kg @ 7,5 10-26 g
Masse de l'atome :
M = 207,2 g mol-1 Û matome = 207,2 u.m.a
1 u.m.a = 1 / N g = 1 / 6,022 1023 = 1,66 10-24 g
matome = 207,2 * 1,66 10-24 @ 3,4 10-22 g
mélectrons / matome@ 2,18 10-4
matome / mélectrons @ 4586
H : Z = 1 et M = 1,008
M = 1,008 g mol-1 Û A = 1 Þ N = A - Z = 1 - 1 = 0
Masse des électrons :
mélectrons = Z * me = 1 * 9,1095 10-31 @ 9,1 10-31 kg @ 9,1 10-28 g
Masse de l'atome :
M = 1,008 g mol-1 Û matome = 1,008 u.m.a
1 u.m.a = 1 / N g = 1 / 6,022 1023 = 1,66 10-24 g
matome = 1,008 * 1,66 10-24 @ 1,67 10-24 g
mélectrons / matome @ 5,44 10-4
matome / mélectrons @ 1839
Pour les atomes "légers" (comme H) et à plus forte raison pour les atomes "lourds" (comme Pb) la masse des électrons est toujours négligeable.
La masse de l'atome est concentrée dans son noyau.
Cu : Z = 29
Isotope 1 : M1 = 62,929 g mol-1 Û A1 = 63 Þ N1 = 34
29 protons ; 29 électrons et 34 neutrons
Isotope 2 : M2 = 64,927 g mol-1 Û A2 = 65 Þ N1 = 36
29 protons ; 29 électrons et 36 neutrons
M = S xi Mi
Mcu = x1 M1 + x2 M2
S xi = 1 Þ x1 + x2 = 1 Þ x2 = 1 - x1
Mcu = x1 M1 + (1 - x1) M2 = x1 M1 + M2 + x1 M2
Mcu - M2 = x1 ( M1 - M2 )
x1 = (Mcu - M2 ) / (M1 - M2 ) = (63,540 - 64,927 ) / ( 62,929 - 64,927 ) = 0,6942

MCl = 0,75 * 35 + 0,25 * 37 = 35,5 g.mol-1
Molécule |
Masse Molaire (Mi) | Abondance (xi) |
35Cl – 35Cl |
70 |
0,75 * 0,75 = 0,5625 |
37Cl – 37Cl |
74 |
0,25 * 0,25 = 0,0625 |
35Cl – 37Cl ou 37Cl – 35Cl |
72 |
2 * 0.25 * 0,75 = 0,375 |
Vérifications possibles : S xi = 1 et MCl2 = 2 * 35,5 = 71 = S ( xi Mi )
Potassium K :
| Isotope | Masse Molaire | Abondance |
| Isotope 1 (K 39) | M1 = 38,9677 | x1 |
| Isotope 2 (K 40) | M2 = 39,9640 | x2 = 0,00012 |
| Isotope 2 (K 41) | M3 = 40,9618 | x3 |
M = S xiMi
MK = x1 M1 + x2 M2 + x3 M3
x1 + x2 + x3 = 1
x2 = 0,00012 Þ x1 + x3 = 0,99988 Þ x3 = 0,99988 - x1
MK = x1 M1 + 0,00012 M2 + ( 0,99988 - x1 ) M3
MK = x1 M1 + 0,00012 M2 + 0,99988 M3 - x1 M3
MK - 0,00012 M2 - 0,99988 M3 = x1 ( M1 - M3 )
x1 = ( MK - 0,00012 M2 - 0,99988 M3 ) / ( M1 - M3 )
x1 = ( 39,102 - 0,00012 * 39,4640 - 0,99988 * 40,9618 ) / ( 38,9637 - 40,9618 )
x1 = 0,93072 et x3 = 0,06916

Isotope 39 : Z = 19 ; N = 39 - 19 = 20 neutrons
Masse "théorique" du noyau : mthéorique = ( 19 * 1,00727) + ( 20 * 1.00866 ) = 39,311 u.m.a
Masse réelle du noyau : mréelle @ 38,9637 u.m.a
La masse réelle du noyau est inférieure à sa masse théorique.
Perte de masse : Dm = 39,311 - 38,9637 = 0,348 u.m.a / noyau = 0,348 g / mole de noyau
Cette perte de masse correspond à l'énergie de cohésion du noyau (plus stable que ses composants séparés) par la relation d'Einstein E = Dm C2
E = 0,348 * ( 3 108 ) 2 @ 3,132 1013 J / mole de noyau
E @ 3,132 1013 / 1,6 10-19 @ 1,96 1032 eV/mole de noyau @ 1,96 1026 MeV/mole de noyau
E @ 1,96 1026 / 6,022 1023 @ 325,5 MeV / noyau
E @ 325,5 / 39 = 8,4 MeV / nucléon
Moyen de vérification : L'énergie de cohésion moyenne étant comprise entre 7,5 et 8,8 MeV/nucléon pour les atomes stables de A > 15 (voir cours : Courbe d'Aston) ce résultat est donc tout à fait plausible.
Uranium 235 : Z = 92 et N = 235 - 92 = 143
Masse "théorique" :
Mthéorique = 92 * 1.00727 + 143 * 1,00866 = 236,907 u.m.a
Défaut de masse :
Dm = 236,907 - 235,044 = 1,863 u.m.a / noyau = 1,863 10-3 Kg / mole de noyaux
Energie de cohésion :
E = Dm * C2 = 1,863 10-3 * ( 3 108 )2 = 1,679 1014 J / mole de noyau
E = 1,05 1033 eV / mole de noyau
E = 1,05 1027 MeV / mole de noyau
E = 1,05 1027 / 6,022 1023 = 1740 MeV / noyau
E = 1740 / 235 = 7,4 MeV / nucléon
(Résultat cohérent avec la courbe d'Aston)
Réaction de fission :
Deux écritures sont possibles :
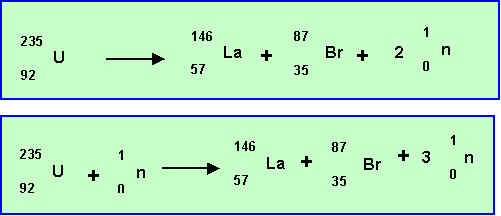
Perte de masse :
Dm = 235,044 - 145,933 - 86,912 - ( 2 * 1,00866) = 0,172 u.m.a = 0,172 10-3 kg / mole
Energie dégagée :
E = Dm C2 = 0,172 10-3 * ( 3 108 )2 = 1,545 1013 J / mole
E = 1,545 1013 J / 235 g de 235U
E = 1,545 1013 J / 235 = 6,57 1010 J / g de 235U = 6,57 1013 J / kg de 235U
Masse de charbon équivalente :
MC = 6,57 1013 / 33400 103 = 1968403 Kg @ 2000 tonnes
La fission de 1 g d'Uranium dégage autant d'énergie que la combustion de 2 t de charbon.
Les réactions nucléaires sont beaucoup plus énergétiques que les réactions chimiques, cela explique l'utilisation des centrales nucléaire malgré tous les problèmes qu'elles posent.