
SPECTRE DE L'HYDROGENE ET DES HYDROGENOIDES
n = C / l = 3 108 / 200 10-9 = 1,5 1015 Hz
s = 1 / l = 1 / 200 10-9 = 5 106 m-1
E = h n = 6,62 10-34 * 1,5 1015 = 9,915 10-19 J = 6,2 eV

Passage de l’infini à n :
1 / l1 = RH (1/n2 –1/p2) = RH / n2 => l1 = n2 / RH
Passage de n + 1 à n :
1 / l2 = RH (1/n2 –1/(n+1)2) = RH [ (n + 1)2 - n2] / [n2 (n+1)2] => l2 = n2 (n + 1)2 / [ ( 2n + 1 ) RH]
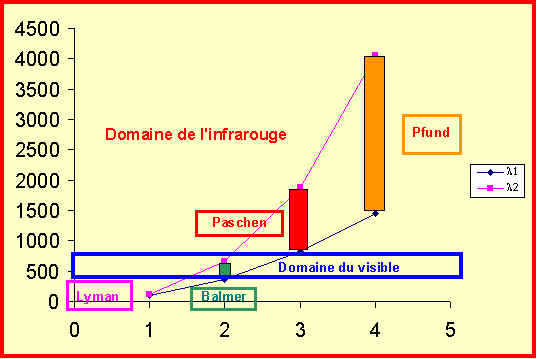
Série |
l1 ( nm) |
l2 (nm) |
Lyman (n = 1) |
91 |
122 |
Balmer ( n = 2 ) |
365 |
656 |
Paschen ( n = 3 ) |
820 |
1875 |
Pfund ( n = 4 ) |
1458 |
4051 |
Remarque :
Les séries sont de plus en plus étalées et on observe un chevauchement dès n = 4.
On finit donc pour n élevé par obtenir un spectre quasi continu.
Pour certains atomes émettant dans le visible, on pourra donc obtenir une lumière pratiquement blanche, d’où l’utilisation pour l’éclairage "au néon ".
Visible de 400 à 750 nm.
Représentation graphique.
E0 = h C RH = 6,62 10-34 * 3 108 * 1,09677 107= 2,18 10-18 J = 13,61 eV
DEn,p = En - Ep = ( -E0 / n2 ) - ( -E0 / p2 ) = E0 ( 1/p2 - 1/n2 ) avec n > p
DE¥ ,2 = E0 (1/4 - 1/¥ ) = E0 / 4 = 2,18 10-18 / 4 = 0,545 10-18 J = 3,4 eV
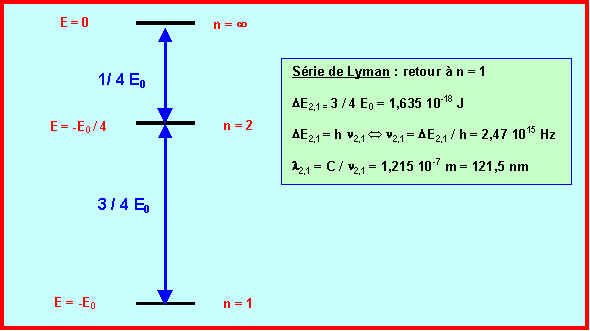
DEp,n = E0 (1/p2-1/n2) avec n > p
DE2,1 = E0 (1/12-1/22) = 3/4 E0 = 3/4 * 13,54 = 10,155 eV = 1,62 10-18 J
DE¥ ,2 = E0 ( 1 / 22 - 1 / ¥ 2) = 1/4 E0 = 1/4 * 13,54 = 3,38 eV = 5,4 10-19 J
DE = h n Û n = DE / h = C / l Û l = h C / DE
l ¥ ,2 = h C / DE¥ ,2 = 6,62 10-34 * 3 108 / 5,4 10-19 = 3,678 10-7 m = 367,8 nm
l 2,1 = h C / DE2,1 = 6,62 10-34 * 3 108 / 1,62 10-18 = 1,226 10-7 m = 122,6 nm
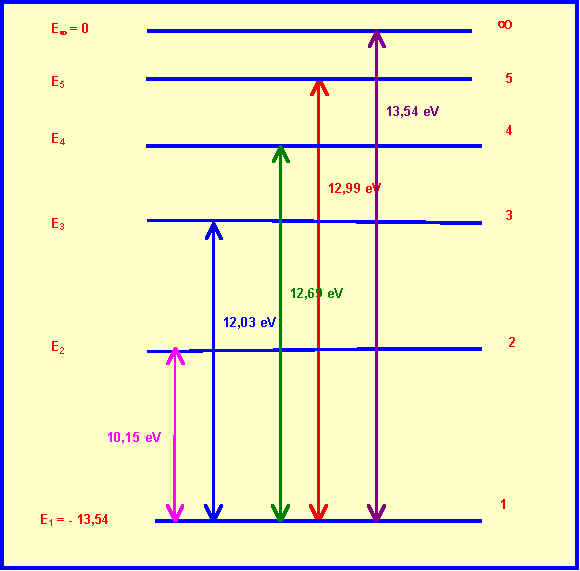
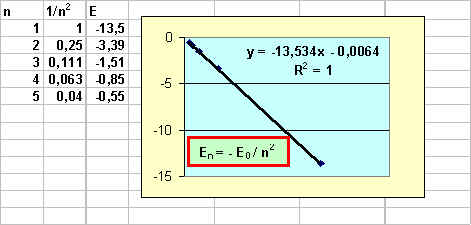
E2 - E1 = 10,15 Þ E2 = 10,15 + E1 = 10,15 - 13,54 = -3,39 ev
E3 - E1 = 12,03 Þ E3 = 12,03 + E1 = 12,03 - 13,54 = -1,51 ev
E4 - E1 = 12,69 Þ E4 = 12,69 + E1 = 12,69 - 13,54 = -0,85 ev
E5 - E1 = 12,99 Þ E5 = 12,99 + E1 = 12,99 - 13,54 = -0,55 ev
En portant E = f ( 1 / n2 ) on obtient bien une droite de pente -E0 = -13,54 eV et passant par l'origine donc E = -E0 / n2
a) DE4,1 = E4 - E1 = ( -E0 / 16 ) + E0 = 15 / 16 E0 = 12,75 eV
b) DE¥ ,4 = E¥ - E4 =0 - -E0 / 16 = 1 / 16 E0 = 0,85 eV
c) DE4,3 = E4 - E3 = ( -E0 / 16) + ( E0 / 9 ) = E0 ( 1/9 - 1/16 )= 0,661 eV = 1,06 10-19 J
n4,3 = DE4,3 / h = 1,06 10-19 / 6,62 10-34 = 1,6 1014 Hz
Atomes hydrogénoïdes : En = - E0 * [ Z2 / n2 ]
He+ : Z = 2 Þ En = - E0 * [ 22 / n2 ] = - 4 E0 / n2 = - 54,4 / n2
E.I He+ = 54,4 eV
Li2+ : Z = 3 Þ En = - E0 * [ 32 / n2 ] = - 9 E0 / n2 = - 122,4 / n2
E.I Li2+ = 122,4 eV
Be3+ : Z = 4 Þ En = - E0 * [ 42 / n2 ] = - 16 E0 / n2 = - 217,6 / n2
E.I Be3+ = 217,6 eV
b) Balmer : retour à n = 2
DE3,2 = E3 - E2 = - 54,4 / 22 + 54,4 / 32 = 54,4 (1/4 - 1/9) = 7,556 eV = 1,21 10-8 J
l = h c / DE = 164,3 nm
DE¥ ,2 = E¥ - E2 = - 54,4 / 4 = 13,6 eV = 2,18 10-18 J
l = h c / DE = 91,3 nm
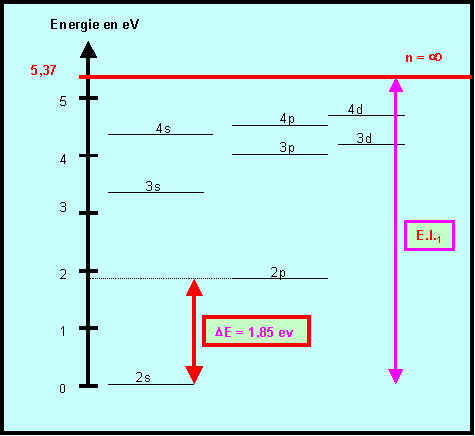
1) Calcul de l'énergie associée :
E = h n = h C / l = 6,62 10-34 * 3 108 / 671 10-9 = 2,96 10-19 J = 1,85 eV
2) Pourquoi le niveau 2s est-il pris comme niveau zéro pour l’énergie ?
La configuration du Lithium est [He] 2s1 ou 1s2 , 2s1
Le niveau 2s est donc le dernier niveau occupé dans l'état fondamental de l'atome de Lithium.
Ce sont les électrons situés sur ce niveau qui pourront " sauter " sur un niveau supérieur par excitation, il est donc pris comme référence pour l'énergie. C'est le niveau fondamental de l'atome de lithium.
3) Que représente la valeur 5,37 eV ?
Il s'agit de l'énergie d'ionisation de l'atome de Lithium à partir de son état fondamental 2s1, c'est l'énergie qu'il faut fournir pour amener l'électron du niveau fondamental à l'infini c'est à dire pour ioniser Li en Li+. (voir figure)
4) A quelle transition électronique peut être attribuée la raie d'émission rouge ( l = 671 nm) du spectre du Lithium ?
La transition dont l’énergie vaut 1,85 eV est la transition entre les niveaux 2s et 2p
(voir figure)