Exercice 4 :
4-1 ) : Pour la série des composés hydrogénés de la colonne de l’oxygène (H2O,H2S,H2Se,H2Te) on a trouvé les valeurs suivantes pour les angles HXH :
HOH 104,5° - HSH 93,3° - HSeH 91,0° - HTeH 89,5°
4-1-a) : Justifier la valeur trouvée pour H2O
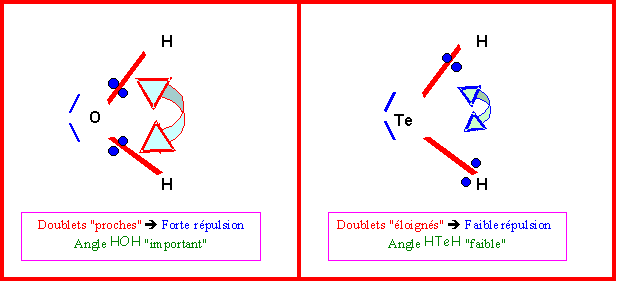
La géométrie autour de l’atome d’oxygène est du type AX2E2.
On doit donc avoir des angles proche de 109,5 ° (tétraèdre).
Les fortes répulsions entre les deux doublets libres referme l'angle HOH qui passe donc à 104,5°.
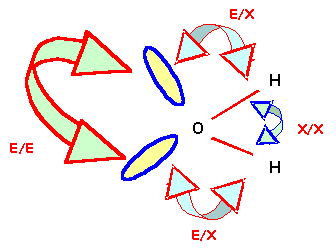
Rappelons l'ordre des répulsions entre doublets :
E / E > E / X > X / X
avec : E = doublet libre et X = doublet de liaison

4-1-b ) : Quelle raison peut-on invoquer pour justifier la diminution de l’angle quand on passe de O à Te ? Justifier cette évolution à l’aide de schémas.
L'électronégativité décroît quand on descend le long d'une colonne de la classification.
On a donc dans l'ordre : XO > XS > XSe > XTe
Les doublets des liaisons se rapprochant de l'atome le plus électronégatif on va observer une évolution de l'angle HXH dû a un effet "électrostatique" plus les charges sont proches et plus elles se repoussent d'après la loi de Coulomb.
Les répulsions X/X seront donc plus importantes :
- dans H2O que dans H2S
- dans H2S que dans H2Se
- dans H2Se que dans H2Te
On observera corrélativement une diminution de l'angle HXH quand on passera de H2O à H2Te.
4-2) Pour la série des composés halogénés de l’arsenic (AsF3, AsCl3, AsBr3 , AsI3) on a trouvé les valeurs suivantes pour les angles XAsX :
FAsF : 102,0° ± 2°
ClAsCl : 98,4° ± 0,5°
BrAsBr : 100,5° ± 1,5°
IAsI : 101,0° ± 1,5°
4-2-a) Montrer que la seule électronégativité ne peut justifier l’évolution observée.
Dans ce cas l'atome central est le même et l'atome latéral varie.
L'électronégativité évolue dans l'ordre XF > XCl > XBr > XI
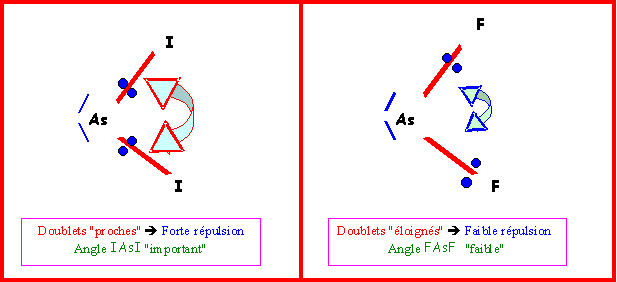
Si la seule électronégativité intervenait, l'angle XAsX devrait donc décroître régulièrement en passant de F à Cl puis à Br puis à I. Ce n'est pas le cas puisque si l'on observe bien une diminution en passant de F à Cl on observe ensuite des augmentations en passant de Cl à Br puis à I.
4-2-b) Quelle autre raison peut alors justifier cette évolution ?
L'évolution de la taille des atomes peut expliquer cette évolution. Les atomes de Brome et d'Iode sont de très gros atomes et il occupent un volume important. Ils ont donc besoin d'un angle très ouvert pour pouvoir se loger d'ou l'augmentation observée. Ce genre d'effet dû à la taille des atomes (ou des groupements atomiques) porte le nom générique d'effet d'encombrement stérique et est assez fréquemment rencontré, en particulier en chimie organique.