Retour au sommaire des exercices sur les Molécules
PREMIERE SERIE DE T.D
Structures de Lewis des molécules - Mésomérie
Prévision des géométries moléculaires par la méthode V.S.E.P.R
L’atome dont le symbole est souligné est l’atome central
Les rayons de covalence des atomes seront évalués par la formule
R (A°) = 0,215 (n*2/Z*) + 0,148 n* + 0,225
(avec n*=n pour n=1 ou n=2 ; n*=3.6 pour n=4 et n*=4 pour n=5
Pour H on prendra RH = 0,346 A°
Les longueurs de liaisons (en A°) seront évaluées par la formule dA-B = 1,11 dCalc - 0,203
(dCalc = somme des rayons de covalence en A°)
ou plus simplement, sans passer par l’intermédiaire des rayons de covalence
L (A°) = 0,239 S (n*2/Z*) + 0,164 S n* + 0,297 (Attention H ne marche pas !)
Liaison double = 86 % de la simple - Liaison triple = 78% de la simple
Exercice 1 :
1) Prévoir les formules des dérivés hydrogénés probables des éléments suivants :
Li - O - N - Cl - As(Z=33) - Si - Ne - C - S - Na
2) Le carbone donne deux composés différents avec l’oxygène CO et CO2.
Justifier l’existence de ces deux composés.
Exercice 2 :
Pour les molécules ou ions suivants :
a) Proposer une structure de Lewis.
b) Par application de la Méthode V.S.E.P.R déterminer la géométrie.
AlCl3 ; SO2 ; PO43- ; CO32- ; H3 O+ , NO2- ; NO2+ , XeF4 , XeO3
CORRIGE : AlCl3 ; SO2 ; PO43- ; CO32-
CORRIGE : H3 O+ , NO2- ; NO2+ , XeF4 , XeO3
Exercice 3 :
Le composé le plus simple entre l’azote et le carbone est le composé de formule CN.
Ce composé est très instable mais a néanmoins été détecté dans l’espace interstellaire et dans l’atmosphère de certaines comètes. Les données expérimentales concernant ce composé montre que la longueur de la liaison CN est de 1,1718 A°.
1) Utilisation du modèle de Lewis
Quelle particularité électronique explique l'instabilité du composé CN ?
Comment appelle-t-on ce type de composé ?
Proposez pour ce composé deux structures de Lewis différentes dans lesquelles on attribuera l’électron célibataire à l’atome d’Azote (structure A) ou à l’atome de Carbone (structure B).
On se limitera aux seules formes mésomères NON-CHARGEES
A partir du radical CN on peut obtenir un composé hydrogéné de formule brute NCH (éléments classés dans l'ordre alphabétique de leur nom).
Proposer deux structures de Lewis A’ (dérivant directement de A) et B’ (dérivant directement de B) pour ce composé hydrogéné.
Prévoir la géométrie moléculaire, les angles et les longueurs des liaisons pour les deux structures A’ et B’.
Il existe bien un composé stable de formule NCH. Ce composé est nommé acide cyanhydrique et est un gaz extrêmement toxique et mortel même à très faibles doses. La détermination expérimentale de la géométrie de ce composé montre qu’il s’agit d’une molécule linéaire contenant deux liaisons différentes de longueurs respectives : 1,0657 A° et 1,1530 A°.
Quelle structure A’ ou B’ vous semble convenir pour ce composé ?
Attribuer les deux longueurs de liaisons expérimentales.
En déduire la structure de Lewis probable (structure A ou structure B) du radical CN.
Exercice 4 :
4-1 ) : Pour la série des composés hydrogénés de la colonne de l’oxygène (H2O , H2S , H2Se , H2Te) on a trouvé les valeurs suivantes pour les angles HXH :
HOH 104,5° - HSH 93,3° - HSeH 91,0° - HTeH 89,5°
4-1-a) : Justifier la valeur trouvée pour H2O
4-1-b ) : Quelle raison peut-on invoquer pour justifier la diminution de l’angle quand on passe de O à Te ? Justifier cette évolution à l’aide de schémas.
4-2) Pour la série des composés halogénés de l’arsenic (AsF3, AsCl3, AsBr3 , AsI3) on a trouvé les valeurs suivantes pour les angles XAsX :
FAsF : 102,0° +/- 2°
ClAsCl : 98,4° +/- 0,5°
BrAsBr : 100,5° +/- 1,5°
IAsI : 101,0° +/- 1,5°
4-2-a) Montrer que la seule électronégativité ne peut justifier l’évolution observée.
4-2-b) Quelle autre raison peut alors justifier cette évolution ?
Exercice 5 :
Déterminer la géométrie de : ClF3 ; I3- ; ICl2- ; PF4Cl ; PCl4F ; PCl4I
Exercice 6 :
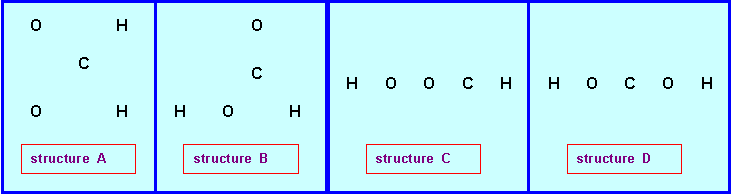
Soit la molécule de formule brute CH2O2 :
On peut envisager (entre autres) les enchaînements d’atomes suivants pour cette molécule

1) Proposer pour chacun de ces enchaînements une structure de Lewis moléculaire.
On fera apparaître les divers types de liaisons (simples, doubles ou triples) ainsi que les éventuels doublets libres et/ou cases quantiques vides.
2) Donner dans chaque cas la géométrie prévue par la méthode V.S.E.P.R. On précisera la valeur prévue pour les divers angles de liaison.
3) A partir des valeurs des rayons de covalence des atomes C, H et O on estimera les diverses longueurs de liaisons dans chaque cas (formules données plus haut)
4) Cette molécule existe réellement, il s’agit de l’acide méthanoïque (ou formique) HCOOH (structure B) et on a pu déterminer expérimentalement les diverses longueurs de liaisons ainsi que les divers angles de liaisons. On a trouvé les résultats suivants :
Longueurs des liaisons ( A°) : 0,95 - 1,09 - 1,25 - 1,31
Angles de liaisons ( °) : 108 - 118 - 118 - 124
a) Attribuer les diverses longueurs de liaisons observées.
b) Pour une des liaisons l’accord entre valeur calculée et expérimentale est nettement moins bon que pour les autres.
De quelle liaison s’agit-il ?
Montrer qu’il est possible d’expliquer ce mauvais accord par l’existence d’une forme mésomère faisant intervenir un des doublet libres de l’atome d’oxygène.
Montrer d’autre part que l’intervention de cette forme mésomère permet d’expliquer l’acidité importante (pKa=3,7) de l’acide formique.
Montrer de même que l’anion formiate HCOO- dont on donnera la structure de Lewis est fortement stabilisé par effet mésomère.
c) Attribuer les divers angles de liaison observés.