MODELE DE LEWIS - METHODE V.S.E.P.R
Exercice 1 :
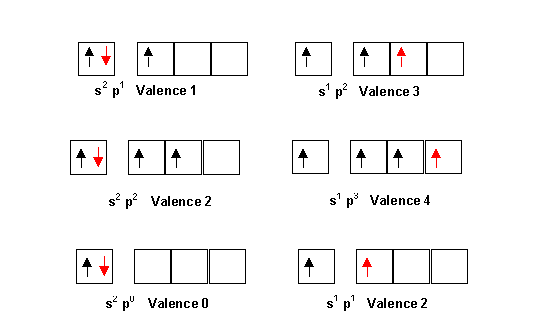
La prévision a priori des formules se fait dans les cas les plus simples en se basant sur la notion de valence des éléments. La valence correspond le plus souvent au nombre d'électron célibataire présent sur la couche de valence de l'élément étudié. Dans le modèle de Lewis se sont ces électrons célibataires qui formeront le plus souvent les liaisons chimiques en s'associant avec un autre électron célibataire d'un autre atome. Le doublet ainsi constitué formant la liaison chimique. Il faut toutefois tenir compte de la possibilité d'excitation des atomes, qui peut modifier la valence de ceux-ci. Ainsi les configurations électroniques de type s2 p1 a un seul électron célibataire pourront facilement se transformer en s1 p2 a trois électrons célibataires. La valence passant alors de 1 à 3. De même les configurations en s2 p2 de valence 2 conduiront facilement à la valence 4 par excitation en s1 p3. Enfin les configuration en s2 de valence 0 pourront par excitation en s1 p1 conduire à la valence 2. Il existe encore d'autres types d'excitations qui seront envisagées plus loin.

Compte tenu de ces diverses possibilités on peut résumer les valences courantes des éléments à partir de leur place dans la classification. Soit le tableau suivant. Pour les éléments courants dont la position doit être parfaitement connue.
En rouge est indiquée la valence "normale" la plus fréquemment rencontrée.
| Configuration | s1 |
s2 |
p1 |
p2 |
p3 |
p4 |
p5 |
p6 |
Valence courante |
1 |
0 ou 2 |
1 ou 3 |
2 ou 4 |
3 |
2 |
1 |
0 |
H |
He |
|||||||
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
|
K |
Ca |
Br |
Kr |
|||||
I |
Xe |
|||||||
Rn |
Ici nous envisageons des molécules hydrogénées de divers éléments, les formules seront déduites simplement par la valence de l'élément lié à H puisque celui-ci a la valence 1.
LiH - NaH - CH2 ou CH4 - SiH2 ou SiH4 - NH3 - OH2 - SH2 - ClH
Le Néon gaz inerte de valence 0 ne donnera pas de composés stables.
On remarque bien entendu que les éléments appartenant à une même colonne donneront un composé de même type, cela est tout à fait normal puisque ayant même configuration leurs propriétés chimiques sont très proches (notion de famille ou groupe chimique).
Nous allons utiliser cette propriété pour prévoir facilement le composé hydrogéné de As dont la position dans la classification n'est pas obligatoirement connue. Il suffit de chercher sa configuration électronique. En utilisant la règle de Klechkowski on obtient :
As Z = 33 = 18 + 15 = (Ar) 3d10 4s2 4p3
Cette configuration le place dans la colonne de l'azote et on aura donc AsH3.
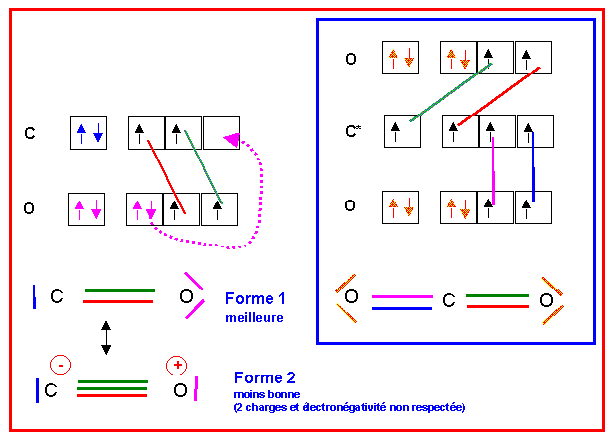
2) Nous avons vu que le carbone pouvait avoir les valences 2 ou 4. L'oxygène ne possède lui que la valence On pourra donc obtenir CO (monoxyde de carbone) ou CO2 (dioxyde de carbone). Les schémas de Lewis moléculaires se déduisent facilement de ceux des atomes.