Exercice 2 : (deuxième partie)
H3O+ ; NO2- ; NO2+ ; XeO3 ; XeF4
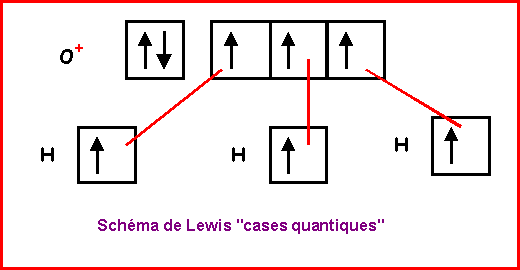
H3O+
Méthode rapide :
O central : 6 électrons.
On enlève 1 électron a cause de la charge positive soit 5 électrons.
H latéral possède 1 électron célibataire et fait donc 1 liaison simple avec O.
O central fait donc 3 liaisons avec les 3 H et il lui reste donc 5 - 3 = 2 électrons soit 1 doublet libre. On obtient alors le schéma de Lewis provisoire suivant :

Cette forme provisoire présente le défaut apparent de faire porter une charge positive sur l'atome le plus électronégatif. Il n'est pas possible de le corriger en déplaçant un doublet de liaison de H vers O car la liaison covalente serait brisée pour donner H2O et H+. En effet, H ne possède pas de doublet libre qui pourrait se déplacer simultanément pour compenser.
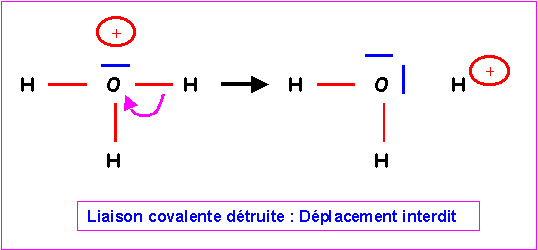
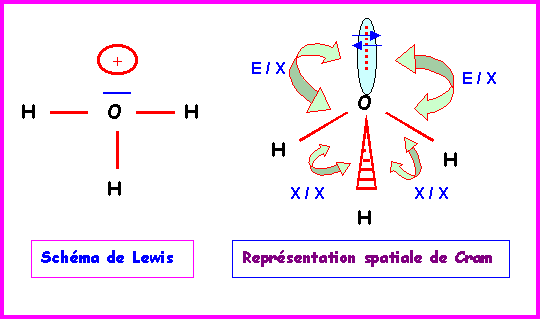
Finalement le schéma de Lewis obtenu est donc le bon.
La géométrie autour de l'atome central est du type AX3E.
On aura donc affaire à un tétraèdre auquel il manquera un sommet. Soit finalement à une structure pyramidale à base triangulaire avec des angles HOH proches de 109°.
En raison des répulsions doublet libre / doublet de liaison ( E / X ) plus importante que les répulsions doublet de liaison / doublet de liaison ( X / X ) l'angle HOH sera en réalité légèrement inférieur a 109°.
NO2-
Nous allons ici pour changer utiliser la technique des cases quantiques.
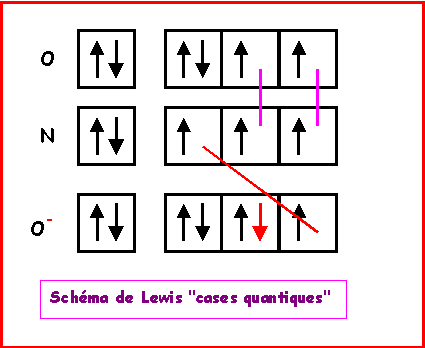
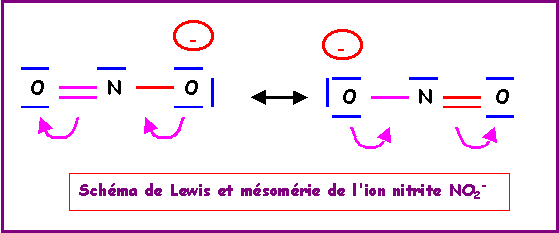
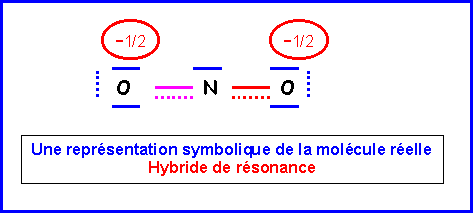
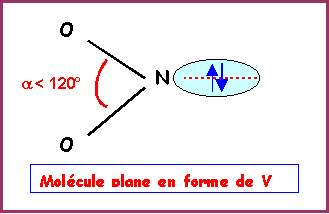
La molécule présente une géométrie de type AX2E autour de l'atome d'azote central.
On aura donc affaire à un triangle équilatéral amputé d'un sommet soit une molécule en forme de V avec un angle ONO légèrement inférieur à 120° a cause des répulsions "doublet libre / doublet de liaison" plus importantes que les répulsions "doublet de liaison / doublet de liaison".
NO2+
Nous allons ici aussi utiliser la technique des cases quantiques.
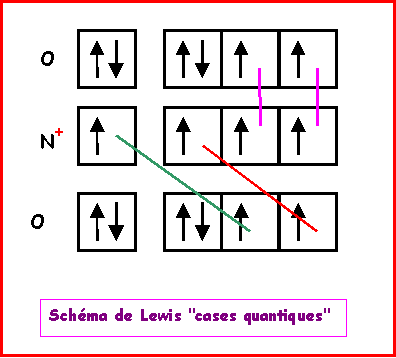
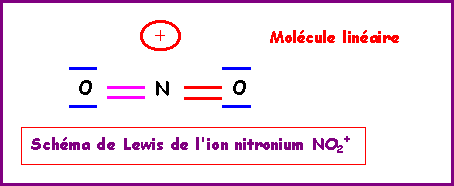
La molécule présente une géométrie de type AX2 autour de l'atome d'azote central soit une molécule linéaire.
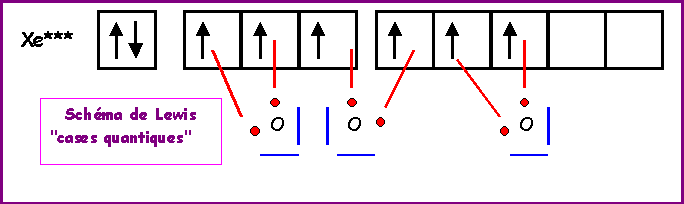
XeO3
Méthode rapide :
L'atome central Xe possède 8 électrons de valence.
L'atome latéral O possède 2 électrons célibataire et forme donc une double liaison.
Xe forme donc 6 liaisons avec les 3 O et il lui reste donc 8 - 6 = 2 électrons soit 1 doublet libre.
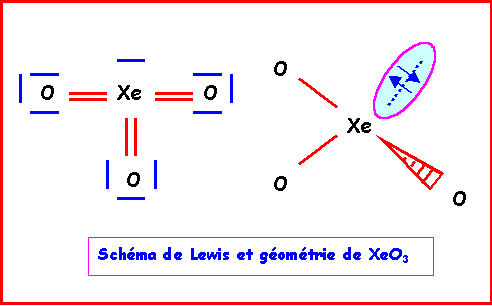
Comme pour H3O+, la géométrie est du type AX3E autour de l'atome central.
On a donc affaire à un tétraèdre amputé d'un sommet.
Les angles OXeO sont légèrement inférieur à 109°, la molécule est en forme de pyramide à base triangulaire.
Remarque : Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc que très difficilement des composés chimiques stables, et ce n'est qu'en 1962 qu'on réussit à synthétiser de tels composés. C'est la grande réactivité de l'Oxygène et notamment sa forte électronégativité qui expliquent que XeO3 existe. Les liaisons sont formées en utilisant les cases 5 d vides du Xénon.
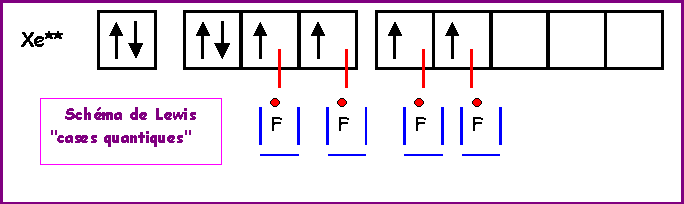
XeF4
Méthode rapide :
L'atome central Xe possède 8 électrons de valence.
L'atome latéral F possède 1 électron célibataire et forme donc une simple liaison.
Xe forme donc 4 liaisons avec les 4 F et il lui reste donc 8 - 4 = 4 électrons soit 2 doublets libres.
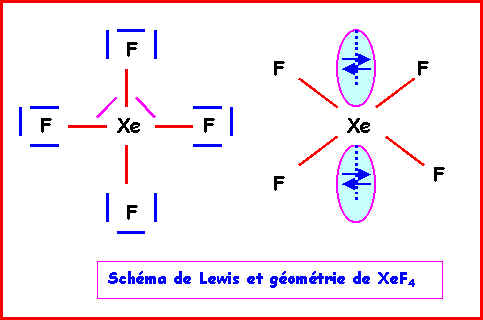
La géométrie est du type AX4E2 autour de l'atome central.
On a donc affaire à un octaèdre amputé de 2 sommets.
Comme les répulsions doublet libre doublet libre sont les plus importantes, les 2 doublets libres se placent à l'opposé l'un de l'autre et la molécule a la forme d'un carré. Les angles FXeF sont tous de 90°, la molécule est plane.
Remarque : Le Xénon est un gaz rare pratiquement inerte chimiquement, il ne donne donc que très difficilement des composés chimiques stables, et ce n'est qu'en 1962 qu'on réussit à synthétiser de tels composés. C'est la grande réactivité du Fluor et notamment sa forte électronégativité qui expliquent que XeF4 existe. Les liaisons sont formées en utilisant les cases 5 d vides du Xénon.